BRCA- Mutation - BRCA mutation
| BRCA-Mutation | |
|---|---|
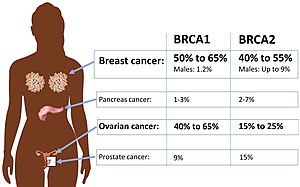 | |
| Absolutes Krebsrisiko bei BRCA1- oder BRCA2- Mutation. | |
| Spezialität | Medizinische Genetik |
Eine BRCA- Mutation ist eine Mutation in einem der BRCA1- und BRCA2- Gene , die Tumorsuppressorgene sind. In diesen Genen wurden Hunderte von verschiedenen Arten von Mutationen identifiziert, von denen einige als schädlich eingestuft wurden, während andere keine nachgewiesenen Auswirkungen haben. Schädliche Mutationen in diesen Genen können bei Betroffenen ein erbliches Brust-Eierstock-Krebs-Syndrom auslösen. Nur 5-10% der Brustkrebsfälle bei Frauen werden auf BRCA1- und BRCA2- Mutationen zurückgeführt (wobei BRCA1- Mutationen etwas häufiger auftreten als BRCA2- Mutationen), aber die Auswirkungen auf Frauen mit der Genmutation sind tiefgreifender. Frauen mit schädlichen Mutationen in entweder BRCA1 oder BRCA2 haben ein ungefähr fünffaches Brustkrebsrisiko und ein ungefähr zehn- bis dreißigfaches Eierstockkrebsrisiko. Das Risiko für Brust- und Eierstockkrebs ist bei Frauen mit einer Hochrisiko- BRCA1- Mutation höher als bei einer BRCA2- Mutation. Eine Mutation mit hohem Risiko garantiert nicht, dass die Frau irgendeine Art von Krebs entwickelt, oder impliziert, dass jeder auftretende Krebs tatsächlich durch die Mutation und nicht durch einen anderen Faktor verursacht wurde.
Hochrisiko-Mutationen, die einen wichtigen fehlerfreien DNA-Reparaturprozess ( homology Directed Repair ) deaktivieren , erhöhen das Risiko einer Person, an Brustkrebs , Eierstockkrebs und bestimmten anderen Krebsarten zu erkranken , erheblich . Warum BRCA1- und BRCA2- Mutationen bevorzugt zu Brust- und Eierstockkrebs führen, ist nicht bekannt, aber die fehlende BRCA1- Funktion scheint zu einer nicht-funktionellen Inaktivierung des X-Chromosoms zu führen . Nicht alle Mutationen sind risikoreich; einige scheinen harmlose Variationen zu sein. Das mit einer bestimmten Mutation verbundene Krebsrisiko variiert erheblich und hängt von der genauen Art und Lage der Mutation und möglicherweise anderen individuellen Faktoren ab.
Mutationen können von beiden Elternteilen vererbt werden und können sowohl an Söhne als auch an Töchter weitergegeben werden. Jedes Kind eines genetischen Trägers , unabhängig vom Geschlecht, hat eine 50%ige Chance, das mutierte Gen von dem Elternteil zu erben, der die Mutation trägt. Infolgedessen ist die Hälfte der Menschen mit BRCA -Genmutationen männlich, die die Mutation dann an 50 % ihrer Nachkommen, männlich oder weiblich, weitergeben würden. Das Risiko von BRCA- assoziiertem Brustkrebs bei Männern mit der Mutation ist höher als bei anderen Männern, aber immer noch gering. Allerdings BRCA Mutationen das Risiko von anderen Krebsarten erhöhen, wie Darmkrebs , Bauchspeicheldrüsenkrebs und Prostatakrebs .
Methoden zur Diagnose der Wahrscheinlichkeit, dass ein Patient mit Mutationen in BRCA1 und BRCA2 Krebs bekommt, wurden durch Patente abgedeckt, die sich im Besitz von Myriad Genetics befinden oder von Myriad Genetics kontrolliert werden . Das Geschäftsmodell von Myriad, den diagnostischen Test exklusiv anzubieten, führte dazu, dass Myriad von einem Startup im Jahr 1994 zu einem börsennotierten Unternehmen mit 1200 Mitarbeitern und einem Jahresumsatz von etwa 500 Millionen US-Dollar im Jahr 2012 heranwuchs; es führte auch zu Kontroversen über hohe Preise und die Unfähigkeit, Zweitmeinungen von anderen diagnostischen Labors einzuholen, was wiederum zu der wegweisenden Klage Association for Molecular Pathology v. Myriad Genetics führte .
Auswirkungen auf die Gesundheit
Frauen mit schädlichen Mutationen im BRCA1- oder BRCA2- Gen haben ein hohes Risiko, an Brust- und/oder Eierstockkrebs zu erkranken . Da unterschiedliche Studien unterschiedliche Populationen untersuchen und unterschiedliche Mutationstypen etwas unterschiedliche Risiken haben, wird das Risiko am besten als Bereich und nicht als einzelne Zahl ausgedrückt.
Ungefähr 50 bis 65 % der Frauen, die mit einer schädlichen Mutation in BRCA1 geboren wurden , entwickeln bis zum 70. Lebensjahr Brustkrebs und 35 bis 46 % entwickeln bis zum 70 BRCA2 wird im Alter von 70 Jahren an Brustkrebs erkranken und 13% bis 23% werden im Alter von 70 Jahren an Eierstockkrebs erkranken.
Frauen mit einem Brustkrebs, der mit einer BRCA- Mutation assoziiert ist, haben eine Wahrscheinlichkeit von bis zu 40 %, innerhalb von 10 Jahren nach der Erstdiagnose einen neuen primären Brustkrebs zu entwickeln, wenn sie keine Tamoxifen- Behandlung erhalten oder sich einer Oophorektomie unterzogen haben . Auch das Zehnjahresrisiko der Frau für Eierstockkrebs ist unter diesen Bedingungen um 6-12% erhöht.
Statistiken zu BRCA- assoziiertem Eierstockkrebs umfassen typischerweise nicht nur Krebs der Eierstöcke selbst, sondern auch Bauchfellkrebs und den sehr seltenen, aber etwas leichter zu erkennenden Krebs der Eileiter . Frauen mit einer BRCA- Mutation haben mehr als das 100-fache der normalen Rate an Eileiterkrebs. Diese drei Arten dieser Krebsarten können in ihren fortgeschrittenen Stadien schwer zu unterscheiden sein.
Krebsausbruch
BRCA- assoziierter Brustkrebs tritt in einem früheren Alter auf als sporadischer Brustkrebs. Es wurde behauptet, dass BRCA- assoziierter Brustkrebs aggressiver ist als normaler Brustkrebs, jedoch weisen die meisten Studien in bestimmten Populationen trotz scheinbar schlechterer prognostischer Faktoren auf einen geringen oder keinen Unterschied in den Überlebensraten hin.
- BRCA1 wird mit dreifach-negativem Brustkrebs in Verbindung gebracht , der nicht auf hormonelle Behandlungen anspricht und mit einigen Medikamenten wie Trastuzumab nicht sinnvoll behandelt werden kann . Brustkrebs tritt oft etwa zwei Jahrzehnte früher auf als normal.
- BRCA2 wird hauptsächlich mit postmenopausalem Brustkrebs in Verbindung gebracht, obwohl das Risiko für prämenopausalen Brustkrebs signifikant ist. Es spricht normalerweise sehr gut auf hormonelle Behandlungen an.
BRCA- bedingter Eierstock- und Eileiterkrebs ist überdurchschnittlich gut behandelbar, da er ungewöhnlich anfällig für eine platinbasierte Chemotherapie wie Cisplatin ist . BRCA1- bedingter Eierstockkrebs tritt in jüngeren Jahren auf, aber das Risiko für Frauen mit BRCA2 steigt in den Wechseljahren oder kurz danach deutlich an.
Überlebenseffekt
72 / 100 | |
46 / 100 | |
|
11 / 100
72 % der Frauen mit einer BRCA1- Mutation und 46 % der Frauen mit einer BRCA2- Mutation (ohne Screening oder medizinische Eingriffe), die vor dem 70. Lebensjahr sterben, sterben an Brust- oder Eierstockkrebs. 11% der Frauen in den USA, die vor dem 70. Lebensjahr sterben, sterben an Brust- oder Eierstockkrebs.
|
| Gruppe | Prozentsatz, der bis zum Alter von 70 Jahren überlebt |
|---|---|
| BRCA1- Mutation |
59
|
| BRCA2- Mutation |
71
|
| Typische Frau |
84
|
Eine 25-jährige Frau ohne Mutation in ihren BRCA- Genen hat eine Wahrscheinlichkeit von 84 %, mindestens 70 Jahre alt zu werden. Von denjenigen, die nicht überleben, sterben 11 % entweder an Brust- oder Eierstockkrebs und 89 % an anderen Ursachen.
Im Vergleich dazu hätte eine Frau mit einer Hochrisiko- BRCA1- Mutation, wenn sie ein Brustkrebs-Screening, aber keine prophylaktische medizinische oder chirurgische Intervention hätte, nur eine Chance von 59 %, das 70. Lebensjahr zu erreichen, 25 Prozentpunkte weniger als normal. Von den nicht überlebenden Frauen würden 26 % an Brustkrebs sterben, 46 % an Eierstockkrebs und 28 % an anderen Ursachen.
Frauen mit Hochrisiko- BRCA2- Mutationen mit Screening, aber ohne prophylaktische medizinische oder chirurgische Intervention hätten nur eine Chance von 71 %, das 70. Lebensjahr zu erreichen, 13 Prozentpunkte weniger als normal. Von denen, die nicht überlebten, starben 21% an Brustkrebs, 25% an Eierstockkrebs und 54% an anderen Ursachen.
Die Wahrscheinlichkeit, bis zum Alter von 70 Jahren zu überleben, kann durch verschiedene medizinische Maßnahmen, insbesondere prophylaktische Mastektomie und Oophorektomie, verbessert werden.
Brustkrebs beim Mann
Männer mit einer BRCA- Mutation haben ein dramatisch erhöhtes relatives Risiko , an Brustkrebs zu erkranken, aber da die Gesamtinzidenz von Brustkrebs bei Männern so gering ist, ist das absolute Risiko gleich oder niedriger als das Risiko für Frauen ohne BRCA- Mutation. Ungefähr 1% bis 2% der Männer mit einer BRCA1- Mutation entwickeln Brustkrebs im Alter von 70 Jahren. Ungefähr 6% der Männer mit einer BRCA2- Mutation entwickeln Brustkrebs im Alter von 70 Jahren, was ungefähr dem Risiko für Frauen ohne BRCA- Mutation entspricht . Sehr wenige Männer mit oder ohne prädisponierende Mutation entwickeln Brustkrebs vor dem 50.
Ungefähr die Hälfte der Männer, die an Brustkrebs erkranken, haben eine Mutation in einem BRCA- Gen oder in einem der anderen Gene, die mit erblichen Brust-Eierstock-Krebs-Syndromen assoziiert sind .
Brustkrebs bei Männern kann genauso erfolgreich behandelt werden wie Brustkrebs bei Frauen, aber Männer ignorieren oft die Anzeichen und Symptome von Krebs, wie eine schmerzende Stelle oder eine ungewöhnliche Schwellung, die möglicherweise nicht größer als ein Reiskorn ist , bis sie ein spätes Stadium erreicht.
Im Gegensatz zu anderen Männern können Männer mit einer BRCA- Mutation, insbesondere einer BRCA2- Mutation, von professionellen und selbst durchgeführten Brustuntersuchungen profitieren . Medizinische Bildgebung wird normalerweise nicht empfohlen, aber da männliche BRCA2- Träger ein Brustkrebsrisiko haben, das dem der allgemeinen weiblichen Bevölkerung sehr ähnlich ist, kann das jährliche Standardprogramm für Mammographien auf diese Männer mit hohem Risiko angepasst werden.
Andere Krebsarten
Mutationen wurden mit einem erhöhten Risiko in Verbindung gebracht, jede Art von invasivem Krebs zu entwickeln, einschließlich Magenkrebs , Bauchspeicheldrüsenkrebs , Prostatakrebs und Dickdarmkrebs . Träger haben das normale Risiko, an Krebs (und anderen Krankheiten) zu erkranken, verbunden mit erhöhtem Alter, Rauchen, Alkoholkonsum, schlechter Ernährung, Bewegungsmangel und anderen bekannten Risikofaktoren, plus das zusätzliche Risiko durch die genetischen Mutationen und eine erhöhte Anfälligkeit für Schäden vor ionisierender Strahlung, einschließlich natürlicher Hintergrundstrahlung .
Männer mit BRCA- Mutationen können keinen Eierstockkrebs bekommen, aber sie können doppelt so häufig an Prostatakrebs erkranken wie Nicht-Träger in einem jüngeren Alter. Für BRCA1- Beförderer ist das Risiko geringer und umstritten ; Bis zu einem Drittel der BRCA2- Mutationsträger wird voraussichtlich vor dem 65. Lebensjahr an Prostatakrebs erkranken. Prostatakrebs bei BRCA- Mutationsträgern tritt in der Regel ein Jahrzehnt früher als normal auf und ist tendenziell aggressiver als normal. Infolgedessen ist ein jährliches Prostata-Screening, einschließlich einer digitalen rektalen Untersuchung , bei bekannten Trägern im Alter von 40 statt im Alter von 50 Jahren angemessen.
Krebs der Bauchspeicheldrüse neigt , in Familien, auch unter den laufen BRCA Familien. Eine BRCA1- Mutation verdoppelt oder verdreifacht ungefähr das Lebenszeitrisiko, an Bauchspeicheldrüsenkrebs zu erkranken; eine BRCA2- Mutation verdreifacht bis verfünffacht sie. Zwischen 4% und 7% der Menschen mit Bauchspeicheldrüsenkrebs haben eine BRCA- Mutation. Da Bauchspeicheldrüsenkrebs jedoch relativ selten ist, haben Menschen mit einer BRCA2- Mutation wahrscheinlich ein absolutes Risiko von etwa 5 %. Wie Eierstockkrebs neigt es dazu, in den frühen, behandelbaren Stadien keine Symptome zu erzeugen. Wie Prostatakrebs tritt Bauchspeicheldrüsenkrebs im Zusammenhang mit einer BRCA- Mutation tendenziell etwa ein Jahrzehnt früher auf als nicht erbliche Fälle. Ein asymptomatisches Screening ist invasiv und kann nur BRCA2- Trägern empfohlen werden, die auch eine Familienanamnese von Bauchspeicheldrüsenkrebs haben.
Melanom ist der tödlichste Hautkrebs, obwohl er im Frühstadium leicht geheilt werden kann. Die normale Wahrscheinlichkeit, ein Melanom zu entwickeln, hängt von der Rasse, der Anzahl der Muttermale , der Familienanamnese, dem Alter, dem Geschlecht und der UV-Strahlung der Person ab. BRCA2- Mutationsträger haben ungefähr das doppelte oder dreifache Risiko, das sie normalerweise hätten, einschließlich eines überdurchschnittlich hohen Risikos für Melanome des Auges .
Krebs des Dickdarms ist etwa so häufig bei Männern und Frauen in der entwickelten Welt wie Brustkrebs bei durchschnittlichem Risiko Frauen, mit etwa 6% der Menschen mit ihm diagnostiziert wird, in der Regel im Alter von 50 Jahren wie sporadischer Prostatakrebs, es ist eine multifaktorielle Krankheit und wird durch Alter, Ernährung und ähnliche Faktoren beeinflusst. Träger einer BRCA- Mutation haben ein überdurchschnittlich hohes Risiko für diese häufige Krebsart, aber das Risiko ist nicht so hoch wie bei einigen anderen erblichen Krebsarten . Das Risiko kann in einigen BRCA1- Familien bis zu viermal so hoch sein wie das normale Risiko bei BRCA2- Trägern. Wie bei Bauchspeicheldrüsenkrebs kann es sein, dass nur einige BRCA- Mutationen oder einige BRCA- Familien das zusätzliche Risiko aufweisen; im Gegensatz zu anderen BRCA- verursachten Krebsarten tritt es nicht in einem früheren Alter als gewöhnlich auf. Für Träger von BRCA- Mutationen wird in der Regel ein normales Darmkrebs-Screening empfohlen .
Mutationen in BRCA1 und BRCA2 sind stark an einigen hämatologischen Malignomen beteiligt . BRCA1- Mutationen sind mit akuter myeloischer Leukämie und chronischer myeloischer Leukämie assoziiert . Mutationen von BRCA2 werden auch bei vielen T-Zell-Lymphomen und chronischen lymphatischen Leukämien gefunden .
Gebärend
Das Dilemma, Kinder zu bekommen oder nicht, kann eine Stressquelle für Frauen sein, die im gebärfähigen Alter von ihren BRCA- Mutationen erfahren .
Es ist wahrscheinlich, dass eine BRCA- Gen-Mutation wenig oder keine Auswirkungen auf die Gesamtfruchtbarkeit hat , obwohl Frauen mit einer BRCA- Mutation eher an einer primären Ovarialinsuffizienz leiden können . Träger von BRCA- Mutationen können mit größerer Wahrscheinlichkeit Mädchen zur Welt bringen als Jungen, jedoch wurde diese Beobachtung auf eine Verzerrung der Ermittlungen zurückgeführt .
Wenn beide Elternteile Träger einer BRCA- Mutation sind, wird manchmal eine genetische Präimplantationsdiagnostik verwendet, um die Geburt eines Kindes mit BRCA- Mutationen zu verhindern . Die Vererbung von zwei BRCA1- Mutationen (eine von jedem Elternteil) wurde nie berichtet und gilt als tödlicher Geburtsfehler. Gelegentlich wurde über die Vererbung einer BRCA1- Mutation und einer BRCA2- Mutation berichtet; das Risiko des Kindes für eine bestimmte Krebsart ist das höhere Risiko der beiden Gene (z. B. das Eierstockkrebsrisiko von BRCA1 und das Bauchspeicheldrüsenkrebsrisiko von BRCA2 ). Die Vererbung von zwei BRCA2- Mutationen führt zu einer Fanconi-Anämie .
Jede Schwangerschaft bei genetisch typischen Frauen ist mit einer signifikanten Verringerung des Brustkrebsrisikos der Mutter nach dem 40. Lebensjahr verbunden. Je jünger die Frau bei ihrer ersten Geburt ist, desto besser ist sie vor Brustkrebs geschützt. Stillen von mehr als einem Jahr schützt vor Brustkrebs. Eine Schwangerschaft schützt auch bei genetisch typischen Frauen vor Eierstockkrebs.
Obwohl einige Studien zu unterschiedlichen Ergebnissen geführt haben, wird von Frauen mit BRCA- Mutationen im Allgemeinen nicht erwartet, dass sie diese signifikanten Schutzvorteile erhalten. Die aktuelle Forschung ist zu begrenzt und zu ungenau, um konkrete Risiken berechnen zu können. Es wurden jedoch die folgenden allgemeinen Trends identifiziert:
- Bei Frauen mit einer BRCA1- Mutation hat das Alter der Frau bei der ersten Geburt keinen Zusammenhang mit ihrem Brustkrebsrisiko. Eine Schwangerschaft bietet keinen Schutz vor Brustkrebs, es sei denn, die Frau hat fünf oder mehr Vollschwangerschaften, zu denen sie nur einen bescheidenen Schutz erhält. Ähnlich wie bei genetisch typischen Frauen schützt eine Schwangerschaft bei BRCA1- Frauen vor Eierstockkrebs . Stillen von mehr als einem Jahr schützt deutlich vor Brustkrebs. Dieser Effekt kann bis zu 19% pro Jahr des Stillens betragen, was viel höher ist als bei genetisch typischen Frauen. Die Auswirkungen von Langzeitstillen auf Eierstockkrebs, falls vorhanden, sind unklar.
- Bei Frauen mit einer BRCA2- Mutation ist paradoxerweise jede Schwangerschaft mit einem statistisch signifikanten Anstieg des Brustkrebsrisikos verbunden. Im Gegensatz zu genetisch typischen Frauen oder Frauen mit BRCA1- Mutationen hat das Stillen bei Frauen mit BRCA2- Mutationen keinen Einfluss auf beide Krebsarten . Begrenzte und widersprüchliche Daten deuten darauf hin, dass eine Schwangerschaft, auch im Gegensatz zu anderen Frauen, das Eierstockkrebsrisiko bei Frauen mit einer BRCA2- Mutation nicht signifikant reduziert und es möglicherweise erhöhen könnte.
Genetik

Beide BRCA- Gene sind Tumorsuppressorgene , die Proteine produzieren, die von der Zelle in einem enzymatischen Weg verwendet werden , der sehr präzise, perfekt abgestimmte Reparaturen an DNA-Molekülen mit Doppelstrangbrüchen durchführt. Der Weg erfordert Proteine, die von mehreren anderen Genen produziert werden, einschließlich CHK2 , FANCD2 und ATM . Schädliche Mutationen in einem dieser Gene deaktivieren das Gen oder das von ihm produzierte Protein.
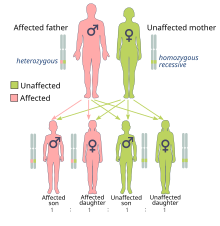
Das durch BRCA1- und BRCA2- Mutationen verursachte Krebsrisiko wird dominant vererbt , obwohl in der Regel nur ein mutiertes Allel direkt vererbt wird. Dies liegt daran, dass Menschen mit der Mutation wahrscheinlich eine zweite Mutation erwerben, die zu einer dominanten Expression des Krebses führt. Ein mutiertes BRCA- Gen kann von beiden Elternteilen vererbt werden. Da sie von den Eltern vererbt werden, werden sie eher als erbliche oder Keimbahnmutationen als als erworbene oder somatische Mutationen klassifiziert . Krebs, der durch ein mutiertes Gen verursacht wird, das von den Eltern einer Person geerbt wird, ist eher ein erblicher Krebs als ein sporadischer Krebs .
Da Menschen ein diploides Genom haben, besitzt jede Zelle zwei Kopien des Gens (eine von jedem biologischen Elternteil). Normalerweise enthält nur eine Kopie eine behindernde, vererbte Mutation, so dass die betroffene Person für die Mutation heterozygot ist . Wenn die funktionelle Kopie jedoch beschädigt wird, ist die Zelle gezwungen, alternative DNA-Reparaturmechanismen zu verwenden, die fehleranfälliger sind. Der Verlust der funktionellen Kopie wird als Verlust der Heterozygotie (LOH) bezeichnet. Alle daraus resultierenden Fehler bei der DNA-Reparatur können zum Zelltod oder zu einer krebsartigen Transformation der Zelle führen.
Es gibt viele Variationen der BRCA- Gene, und nicht alle Veränderungen bergen die gleichen Risiken. Einige Varianten sind harmlos; andere sind bekanntermaßen sehr schädlich. Einige Einzelnukleotid-Polymorphismen können nur ein geringes Risiko übertragen oder können nur in Gegenwart anderer Mutationen oder unter bestimmten Umständen ein Risiko übertragen. In anderen Fällen ist nicht bekannt, ob die Variante schädlich ist. Varianten werden wie folgt klassifiziert:
- Schädliche Mutation : Die Änderung birgt nachweislich erhebliche Risiken. Oft handelt es sich dabei um Frameshift-Mutationen , die verhindern, dass die Zelle mehr als den ersten Teil des notwendigen Proteins produziert.
- Verdacht auf schädlich : Obwohl nichts bewiesen ist, wird die Variation derzeit als schädlich angesehen.
- Variante unsicherer Signifikanz (VUS): Ob die Änderung eine Auswirkung hat, ist ungewiss. Dies ist ein häufiges Testergebnis, und die meisten Variationen begannen in dieser Kategorie. Wenn mehr Beweise gesammelt werden, werden diese neu klassifiziert.
- Variante, Polymorphismus bevorzugen : Obwohl nichts bewiesen ist, wird die Variante derzeit als harmlos angesehen.
- Gutartiger Polymorphismus : Die Veränderung wird als harmlos eingestuft. Diese können als "keine Mutation" gemeldet werden.
Schädliche Mutationen haben eine hohe, aber nicht vollständige genetische Penetranz , was bedeutet, dass Menschen mit der Mutation ein hohes Risiko haben, infolgedessen eine Krankheit zu entwickeln, aber dass einige Menschen trotz einer schädlichen Mutation keinen Krebs entwickeln.
Diagnose
Eine genetische Beratung wird bei Frauen empfohlen, deren persönliche oder familiäre Gesundheitsanamnese eine überdurchschnittliche Wahrscheinlichkeit einer Mutation vermuten lässt. Der Zweck der genetischen Beratung besteht darin, die Person über die Wahrscheinlichkeit eines positiven Ergebnisses, die Risiken und Vorteile eines Tests, die Grenzen der Tests, die praktische Bedeutung der Ergebnisse und die risikomindernden Maßnahmen aufzuklären, die ergriffen werden könnten, wenn die ergebnisse sind positiv. Sie sind auch darin geschult, Menschen bei jeglichen emotionalen Reaktionen zu unterstützen und eine neutrale Person zu sein, die dem Klienten hilft, seine oder ihre eigene Entscheidung in einem Modell der informierten Zustimmung zu treffen , ohne den Klienten zu drängen, das zu tun, was der Berater tun könnte. Da das Wissen um eine Mutation erhebliche Ängste hervorrufen kann, entscheiden sich manche Menschen dafür, sich nicht testen zu lassen oder den Test auf einen späteren Zeitpunkt zu verschieben.
Relative Indikationen zum Testen auf eine Mutation in BRCA1 oder BRCA2 bei neu diagnostizierten oder Familienmitgliedern umfassen eine Familienanamnese bei Verwandten 1. (FDR), 2. (SDR) oder 3. (TDR) Grades, die normalerweise auf derselben Seite der Familie stehen, aber nicht beschränkt sind :
- Eine bekannte Mutation (BRCA1 oder BRCA2) in einem Krebsanfälligkeitsgen innerhalb der Familie
- Frauen, die von Brustkrebs betroffen sind , der unter 30 Jahren diagnostiziert wurde
- Frauen mit dreifach negativem Brustkrebs (TNBC) ( Östrogenrezeptor- negativ, Progesteronrezeptor- negativ und HER2/neu- negativ) unter 50 Jahren
- Zwei Verwandte (FDR/SDR) diagnostiziert unter 45
- Drei Verwandte (FDR/SDR) mit diagnostiziertem Durchschnittsalter von 50 oder weniger
- Vier Verwandte jeden Alters
- Eierstockkrebs mit entweder einem zusätzlichen diagnostizierten Verwandten oder einem Verwandten mit männlichem Brustkrebs
- Ein einzelnes Familienmitglied mit Brust- und Eierstockkrebs
- Brustkrebs beim Mann
- Bauchspeicheldrüsenkrebs mit Brust- oder Eierstockkrebs bei derselben Person oder auf derselben Seite der Familie
- aschkenasische jüdische oder polnische Abstammung mit einem FDR-Familienmitglied, das in jedem Alter von Brust- oder Eierstockkrebs betroffen war
Die Untersuchung von Kleinkindern gilt als medizinisch unethisch, da die Testergebnisse die Art und Weise, wie für die Gesundheit des Kindes gesorgt wird, nicht ändern würden.
Testprozedur
Es stehen zwei Arten von Tests zur Verfügung. Beide verwenden normalerweise eine Blutprobe , obwohl Speicheltests durchgeführt werden können. Der schnellste, einfachste und kostengünstigste Test verwendet positive Testergebnisse von einem Blutsverwandten und prüft nur auf die einzelne Mutation, von der bekannt ist, dass sie in der Familie vorhanden ist. Wenn kein Verwandter zuvor positive Testergebnisse bekannt gegeben hat, kann ein vollständiger Test durchgeführt werden, der die gesamte Sequenz von BRCA1 und BRCA2 überprüft . In einigen Fällen kann die jüdische Ethnizität aufgrund des Gründereffekts verwendet werden, um die Tests einzugrenzen, um schnell auf die drei häufigsten Mutationen bei aschkenasischen Juden zu überprüfen .
Tests werden in der Regel von Krankenversicherungen und öffentlichen Gesundheitsprogrammen für Personen mit hohem Mutationsrisiko und nicht für Personen mit geringem Risiko übernommen. Der Zweck der Beschränkung des Tests auf Personen mit hohem Risiko besteht darin, die Wahrscheinlichkeit zu erhöhen, dass die Person ein aussagekräftiges, umsetzbares Ergebnis aus dem Test erhält, anstatt eine Variante von unbekannter Signifikanz (VUS) zu identifizieren. In Kanada werden Personen, die ihren Hochrisikostatus durch Einhaltung bestimmter Richtlinien nachweisen, zunächst an ein spezialisiertes Programm für erbliche Krebserkrankungen überwiesen, und wenn sie sich für einen Test entscheiden, werden die Kosten für den Test vollständig übernommen. In den USA kosteten 2010 Single-Site-Tests Verkaufskosten von 400 bis 500 US-Dollar und Analysen in voller Länge etwa 3.000 US-Dollar pro Gen.
Der Test wird von einem Arzt, normalerweise einem Onkologen, angeordnet , und die Ergebnisse werden immer an den Arzt und nicht direkt an den Patienten zurückgegeben. Wie schnell Ergebnisse zurückgegeben werden, hängt vom Test ab – die Analyse an einem einzigen Standort erfordert weniger Laborzeit – und von der vorhandenen Infrastruktur. In den USA werden Testergebnisse normalerweise innerhalb von einer bis mehreren Wochen zurückgegeben; in Kanada warten Patienten in der Regel acht bis zehn Monate auf Testergebnisse.
Testinterpretation
Ein positives Testergebnis für eine bekannte schädliche Mutation ist ein Beweis für eine Veranlagung, garantiert jedoch nicht, dass die Person irgendeine Art von Krebs entwickelt. Ein negatives Testergebnis, wenn bekannt ist, dass eine bestimmte Mutation in der Familie vorhanden ist, zeigt, dass die Person keine BRCA- bedingte Veranlagung für Krebs hat, garantiert jedoch nicht, dass die Person keinen nicht erblichen Fall von . entwickelt Krebs. Ein negatives Testergebnis allein bedeutet nicht, dass die Patientin keine erbliche Veranlagung für Brust- oder Eierstockkrebs hat. Die Familie kann eine andere genetische Prädisposition für Krebs haben, an der ein anderes Gen beteiligt ist.
Krebsvorsorge
Es gibt eine Vielzahl von Screening-Optionen und Interventionen, um BRCA- bedingte Krebsrisiken zu managen . Screenings werden an individuelle und familiäre Risikofaktoren angepasst.
Da diese Screening-Methoden Krebs nicht verhindern, sondern lediglich versuchen, ihn frühzeitig zu erkennen, werden mitunter zahlreiche Präventionsmethoden mit unterschiedlichen Ergebnissen praktiziert.
Screening
Frauen mit schädlichen oder vermuteten schädlichen BRCA- Mutationen wird in der Regel ein intensives Krebs-Screening empfohlen , um neue Krebserkrankungen so früh wie möglich zu erkennen. Eine typische Empfehlung sind häufige Brustkrebsvorsorgeuntersuchungen sowie Tests zur Erkennung von Eierstockkrebs.
Brustbildgebungsstudien umfassen in der Regel einmal im Jahr eine Brust-MRT (Magnetresonanztomographie), beginnend im Alter zwischen 20 und 30 Jahren, je nachdem, in welchem Alter bei Verwandten Brustkrebs diagnostiziert wurde. Mammographien werden typischerweise erst im fortgeschrittenen Alter verwendet, da Grund zu der Annahme besteht, dass BRCA- Trägerinnen anfälliger für Brustkrebsinduktion durch Röntgenschäden sind als die allgemeine Bevölkerung.
Alternativen sind Brust- Ultraschall , CT-Scans , PET-Scans , Szintimammographie , Elastographie , Thermographie , duktale Lavage und experimentelle Screening-Protokolle, von denen einige hoffen, Biomarker für Brustkrebs zu identifizieren (Moleküle, die im Blut erscheinen, wenn Brustkrebs beginnt).
Das Screening auf Eierstockkrebs umfasst in der Regel eine Ultraschalluntersuchung der Beckenregion, typischerweise zweimal im Jahr. Frauen können auch einen Bluttest für CA-125 und klinische Beckenuntersuchungen verwenden . Der Bluttest hat eine relativ geringe Sensitivität und Spezifität für Eierstockkrebs.
Sowohl beim Brust- als auch beim Ovarialscreening werden verdächtige Gewebebereiche entweder mit mehr Bildgebung, möglicherweise mit einer anderen Bildgebungsart oder verzögert, oder mit Biopsien der verdächtigen Bereiche untersucht.
Medikation
Antibabypillen sind mit einem wesentlich geringeren Risiko für Eierstockkrebs bei Frauen mit BRCA- Mutationen verbunden. Eine Metaanalyse aus dem Jahr 2013 ergab , dass die Anwendung oraler Kontrazeptiva mit einer 42-prozentigen Reduktion des relativen Risikos für Eierstockkrebs verbunden war, wobei die Assoziation für BRCA1- und BRCA2-Mutationen ähnlich war. Die Anwendung oraler Kontrazeptiva war nicht signifikant mit dem Brustkrebsrisiko verbunden, obwohl ein geringfügiger Anstieg des Risikos beobachtet wurde, der keine statistische Signifikanz erreichte . Eine Metaanalyse aus dem Jahr 2011 ergab, dass die Anwendung von OC mit einer relativen Reduktion des Ovarialkarzinomrisikos um 43 % bei Frauen mit BRCA- Mutationen verbunden war, während die Daten zum Brustkrebsrisiko bei BRCA- Mutationsträgerinnen mit oraler Kontrazeptiva heterogen und die Ergebnisse widersprüchlich waren .
Es wurde festgestellt, dass selektive Östrogenrezeptor-Modulatoren , insbesondere Tamoxifen , das Brustkrebsrisiko bei Frauen mit BRCA- Mutationen, denen die Brust nicht entfernt wurde , verringern . Es ist wirksam als Primärprävention (Verhinderung des ersten Brustkrebsfalls) bei Frauen mit BRCA2- Mutationen, nicht jedoch BRCA1- Mutationen, und als Sekundärprävention (Verhinderung eines zweiten, unabhängigen Brustkrebses) bei beiden Gruppen von Frauen. Es wurde festgestellt, dass die Einnahme von Tamoxifen über einen Zeitraum von fünf Jahren das Brustkrebsrisiko bei Frauen halbiert, die aus irgendeinem Grund ein hohes Brustkrebsrisiko haben, aber möglicherweise schwerwiegende Nebenwirkungen wie Katarakte , Blutgerinnsel und Endometriumkrebs sowie Probleme mit der Lebensqualität wie Hitzewallungen, dazu führen, dass einige Frauen die Anwendung abbrechen und einige Ärzte die Anwendung auf Frauen mit atypischem Wachstum der Brüste beschränken. Tamoxifen ist bei Frauen kontraindiziert , die am wahrscheinlichsten durch die üblichen Komplikationen geschädigt werden. Als Alternative wird Raloxifen (Evista) verwendet, das ein geringeres Nebenwirkungsrisiko aufweist, aber nicht speziell bei Trägern von BRCA- Mutationen untersucht wurde. Die Anwendung von Tamoxifen kann mit einer Oophorektomie kombiniert werden, um das Brustkrebsrisiko noch stärker zu senken, insbesondere bei Frauen mit BRCA2- Mutationen.
Aromatasehemmer sind Medikamente, die die Östrogenproduktion in den Nebennieren und im Fettgewebe verhindern . Sie haben weniger Nebenwirkungen als selektive Östrogenrezeptor-Modulatoren wie Tamoxifen, wirken aber bei prämenopausalen Frauen nicht, da sie die Ovarien nicht an der Östrogenproduktion hindern.
Operation
Es ist bekannt, dass mehrere Arten von präventiven Operationen das Krebsrisiko für Frauen mit Hochrisiko- BRCA- Mutationen erheblich reduzieren . Die Operationen können allein, in Kombination miteinander oder in Kombination mit nicht-chirurgischen Eingriffen durchgeführt werden, um das Risiko von Brust- und Eierstockkrebs zu reduzieren. Beachten Sie, dass Operationen wie Mastektomie und Oophorektomie das Risiko von Brustkrebs nicht vollständig eliminieren; Berichten zufolge sind trotz dieser Verfahren Fälle aufgetreten.
- Die Tubenligatur ist die am wenigsten invasive dieser Operationen und scheint das Eierstockkrebsrisiko für BRCA1- Trägerinnen um über 60 % zu reduzieren . Die Salpingektomie ist eine weitere Option, die invasiver als die Tubenligatur ist und zu einer zusätzlichen Risikominderung führen kann. Beides kann jederzeit nach Beendigung der Geburt durchgeführt werden. Im Gegensatz zu anderen prophylaktischen Operationen verringern diese beiden Operationen das Brustkrebsrisiko nicht.
- Die prophylaktische (präventive) Mastektomie ist mit geringen Risiken und einem starken Rückgang des Brustkrebsrisikos verbunden.
- Die prophylaktische Salpingoophorektomie (Entfernung der Eierstöcke und Eileiter) führt zu einer sehr großen Verringerung des Eierstockkrebsrisikos und zu einer erheblichen Verringerung des Brustkrebsrisikos, wenn sie vor der natürlichen Menopause durchgeführt wird. Es birgt jedoch auch das Risiko erheblicher Nebenwirkungen, wenn es in jungen Jahren durchgeführt wird.
- Die Hysterektomie hat keine direkten Auswirkungen auf BRCA- bedingte Krebsarten, ermöglicht es den Frauen jedoch, einige Medikamente zu verwenden, die das Brustkrebsrisiko (wie Tamoxifen ) mit dem Risiko von Gebärmutterkrebs senken, und weniger Hormone zu verwenden, um die Nebenwirkungen einer prophylaktischen Oophorektomie zu behandeln .
Ob und wann welche Vorsorgeoperationen durchgeführt werden, ist eine komplexe persönliche Entscheidung. Der aktuelle medizinische Kenntnisstand bietet einige Hinweise zu Risiken und Nutzen. Sogar Träger der gleichen Mutation oder aus der gleichen Familie können sehr unterschiedliche Risiken für die Art und Schwere der Krebserkrankung haben, die sie wahrscheinlich bekommen, sowie für das Alter, in dem sie möglicherweise erkranken. Unterschiedliche Menschen haben auch unterschiedliche Werte. Sie können sich auf die totale Krebsprävention, den psychologischen Nutzen, die aktuelle Lebensqualität oder das Gesamtüberleben konzentrieren. Auch für sehr junge Frauen und die Familienplanung können die möglichen Auswirkungen zukünftiger medizinischer Entwicklungen in der Behandlung oder Prognose von Bedeutung sein. Die Entscheidung ist individuell und basiert in der Regel auf vielen Faktoren, wie zum Beispiel dem frühesten Auftreten von BRCA- assoziierten Krebserkrankungen bei nahen Verwandten.
Die Schutzwirkung einer prophylaktischen Operation ist größer, wenn sie in jungen Jahren durchgeführt wird; Die Oophorektomie hat jedoch auch Nebenwirkungen, die am stärksten sind, wenn sie lange vor der natürlichen Menopause durchgeführt wird. Aus diesem Grund wird die Oophorektomie meist nach dem 35. oder 40. Lebensjahr empfohlen, vorausgesetzt, die Geburt ist abgeschlossen. Das Risiko für Eierstockkrebs ist vor diesem Alter gering, und die negativen Auswirkungen der Oophorektomie sind weniger schwerwiegend, wenn sich die Frau der natürlichen Menopause nähert.
- Für Trägerinnen von Hochrisiko- BRCA1- Mutationen reduziert die prophylaktische Oophorektomie um das 40. Lebensjahr das Risiko für Eierstock- und Brustkrebs und bietet einen erheblichen langfristigen Überlebensvorteil. Diese Operation in einem sehr jungen Alter bietet wenig oder keinen zusätzlichen Überlebensvorteil, erhöht jedoch die Nebenwirkungen der Operation. Im Vergleich zu keiner Intervention erhöht diese Operation im Alter von etwa 40 Jahren die Chance der Frau, das 70. Lebensjahr zu erreichen, um fünfzehn Prozentpunkte von 59 % auf 74 %. Die zusätzliche prophylaktische Mastektomie erhöht das erwartete Überleben um einige weitere Prozentpunkte.
- Bei Trägern von Hochrisiko- BRCA2- Mutationen hat die Oophorektomie um das 40. Lebensjahr einen geringeren Effekt. Die Operation erhöht die Chance der Frau, das 70. Lebensjahr zu erreichen, nur um fünf Prozentpunkte von 75 % auf 80 %. Wenn stattdessen im Alter von 40 Jahren nur eine präventive Mastektomie durchgeführt wird, ist die Verbesserung ähnlich, wobei die erwartete Wahrscheinlichkeit von 75 % auf 79 % steigt. Die gemeinsame Durchführung beider Operationen im Alter von etwa 40 Jahren soll die Chance der Frau, das 70. Lebensjahr zu erreichen, von 75 % auf 82 % erhöhen.
Zum Vergleich: Frauen in der Allgemeinbevölkerung haben eine 84-prozentige Chance, 70 Jahre alt zu werden.
Die Forschung hat die Auswirkungen risikomindernder Operationen auf das psychische und soziale Wohlbefinden von Frauen mit einer BRCA-Mutation untersucht. Eine Metaanalyse aus dem Jahr 2019 konnte aufgrund begrenzter Evidenz keine Schlussfolgerungen ziehen, ob Interventionen bei weiblichen BRCA-Trägerinnen helfen können, die psychologischen Auswirkungen einer Operation zu lindern. Weitere Forschung ist erforderlich, um zu dem Schluss zu kommen, wie Frauen, die sich für eine Operation entscheiden, am besten unterstützt werden können.
Mastektomie
Bei einer Frau, die keinen Brustkrebs entwickelt hat, kann das Entfernen der Brüste ihr Risiko, jemals an Brustkrebs zu erkranken, um 90 % reduzieren, auf ein Niveau, das ungefähr halb so hoch ist wie das durchschnittliche Risiko einer Frau.
Bei der bilateralen Mastektomie werden beide Brüste von einem Brustchirurgen entfernt . Die modifizierte radikale Mastektomie wird nur bei Frauen mit diagnostiziertem invasivem Brustkrebs angewendet. Techniken für prophylaktische Mastektomien umfassen:
- Die einfache Mastektomie , die Frauen ohne Brustrekonstruktion empfohlen wird, lässt am wenigsten Brustgewebe im Körper und erreicht daher die größte Risikominderung. Neben der prophylaktischen Anwendung wird es auch von Frauen verwendet, bei denen Krebs in früheren Stadien diagnostiziert wurde.
- Bei der hautsparenden Mastektomie wird das Gewebe der Brust, der Brustwarze und des Warzenhofs entfernt, die "überschüssige" Haut jedoch zur Rekonstruktion belassen. Es hat weniger sichtbares Narbengewebe als eine einfache Mastektomie.
- Bei der brustwarzenschonenden Mastektomie wird das Brustgewebe entfernt, aber die Brustwarze und der Warzenhof bleiben für ein natürlicheres Aussehen intakt.
- Bei der subkutanen Mastektomie wird das Brustgewebe entfernt, aber die Brustwarze und der Warzenhof bleiben intakt. Die Narben sind in der Unterbrustfalte unter der Brust versteckt .
- Warzenhof-erhaltende Mastektomie entfernt das Brustgewebe und die Brustwarze, aber nicht den Warzenhof.
- Die nervenschonende Mastektomie ist ein Versuch, die Nerven zu erhalten, die der Haut über den Brüsten ein Gefühl geben. Brüste, die einer dieser Operationen unterzogen wurden, haben ein viel geringeres Tastgefühl als natürliche Brüste. Nervenschonende Techniken sind ein Versuch, ein gewisses Gefühl in der Brust zu erhalten, mit begrenztem und oft nur teilweisem Erfolg.
Welche Technik verwendet wird, wird durch das Vorliegen einer Krebserkrankung und den allgemeinen Gesundheitszustand sowie durch den Wunsch der Frau nach einer Brustrekonstruktionsoperation aus ästhetischen Gründen , falls vorhanden, bestimmt. Frauen, die sich für ein flaches Brustbild entscheiden oder externe Brustprothesen verwenden, entscheiden sich normalerweise für die einfache Mastektomie mit ihrer größeren Risikominderung.
Die Brustrekonstruktion wird normalerweise von einem plastischen Chirurgen durchgeführt und kann als Teil derselben mehrstündigen Operation begonnen werden, bei der die Brüste entfernt werden. Es wurden mehrere Techniken zur Rekonstruktion verwendet, mit unterschiedlichen Stellen und Ausmaßen der Narbenbildung. Einige Techniken verwenden Gewebe aus einem anderen Körperteil, wie zum Beispiel Fettgewebe aus dem Unterbauch oder gelegentlich Muskeln aus anderen Teilen des Rumpfes. Andere verwenden Brustimplantate , denen möglicherweise Gewebeexpander vorausgehen, um Volumen bereitzustellen. Einige Rekonstruktionstechniken erfordern mehrere Operationen. Danach lassen sich einige Frauen Tätowierungen hinzufügen, um Brustwarzenhöfe zu simulieren oder die Haut zu einer Brustwarze umformen.
Salpingo-Oophorektomie
Oophorektomie (chirurgische Entfernung der Eierstöcke) und Salpingektomie (chirurgische Entfernung der Eileiter) werden Frauen mit BRCA- Mutationen dringend empfohlen . Die Salpingoophorektomie ist die effektivste Methode zur Vorbeugung von Eierstock- und Eileiterkrebs bei Frauen mit einer BRCA- Mutation. Allerdings bleibt ein geringes Risiko für primäres Peritonealkarzinom bestehen, zumindest bei Frauen mit BRCA1- Mutationen, da die Peritonealschleimhaut vom gleichen Zelltyp wie Teile des Eierstocks ist. Es wird geschätzt, dass dieses Risiko in den 20 Jahren nach der Operation zu etwa fünf Fällen von Peritonealkrebs pro 100 Frauen mit schädlichen BRCA1- Mutationen führt.
BRCA2- bedingter Eierstockkrebs tritt tendenziell bei perimenopausalen oder menopausalen Frauen auf, daher wird eine Salpingoophorektomie zwischen 45 und 50 Jahren empfohlen. Wenn sie vor der Menopause durchgeführt wird, profitieren die Frauen auch von einem verringerten Brustkrebsrisiko.
Die Operation wird oft in Verbindung mit einer Hysterektomie (chirurgische Entfernung der Gebärmutter) und manchmal einer Zervixektomie (chirurgische Entfernung des Gebärmutterhalses ) durchgeführt, insbesondere bei Frauen, die Tamoxifen einnehmen möchten , das bekanntermaßen Gebärmutterkrebs verursacht, oder die Gebärmutter haben Myome . Es stehen mehrere Operationstechniken zur Verfügung, einschließlich der laparoskopischen (Schlüsselloch-)Chirurgie. Da etwa 5 % der Frauen mit einer BRCA- Mutation zum Zeitpunkt der geplanten Operation einen unentdeckten Eierstockkrebs haben, sollte die Operation so behandelt werden, als würde sie eine bekannte Krebserkrankung entfernen.
Salpingoophorektomie macht die Frau unfruchtbar (unfähig, Kinder zu gebären). Unfruchtbarkeitsdienste können verwendet werden, um ihre Eizellen zu konservieren , wenn dies gewünscht wird. Da die Vorteile der Operation jedoch kurz vor der Menopause am größten sind, verschieben die meisten Frauen die Operation einfach, bis sie bereits so viele Kinder geboren haben, wie sie möchten.
Die Operation induziert auch künstlich die Wechseljahre, die Hitzewallungen , Schlafstörungen, Stimmungsschwankungen, Scheidentrockenheit, sexuelle Schwierigkeiten, Schwierigkeiten beim Worterinnern und andere medizinische Anzeichen und Symptome verursachen . Die Nebenwirkungen reichen von leicht bis schwer; die meisten können zumindest teilweise behandelt werden. Viele Frauen mit einem BRCA nehmen eine Hormonersatztherapie ein , um diese Effekte zu reduzieren: Östrogen-Progesteron-Kombinationen für Frauen mit einer Gebärmutter und ungehinderte Östrogene für Frauen, deren Gebärmutter entfernt wurde. Östrogen kann Brustkrebs verursachen, aber da die eingenommene Östrogenmenge geringer ist als die von den jetzt entfernten Eierstöcken produzierte Menge, wird das Nettorisiko normalerweise als akzeptabel eingeschätzt.
Einige Quellen gehen davon aus, dass eine Oophorektomie vor dem 50. Lebensjahr das Risiko für Herz-Kreislauf-Erkrankungen verdoppelt und das Risiko von Osteoporose-bedingten Hüftfrakturen in der relevanten Bevölkerungsgruppe erhöht.
Nichtmedizinische Entscheidungen
Angesichts der hohen Risiken und des geringen Nutzens von Lebensstilentscheidungen bei BRCA- Mutationsträgern bietet keine Lebensstilentscheidung ausreichenden Schutz.
Das erste Kind in einem jüngeren Alter zu bekommen, mehr Kinder als der Durchschnitt zu bekommen und länger als ein Jahr zu stillen, verringert das Brustkrebsrisiko einer Frau mit durchschnittlichem Risiko. Studien zu diesem Effekt bei Trägern von BRCA- Mutationen haben zu widersprüchlichen Ergebnissen geführt, aber im Allgemeinen wird angenommen, dass Kinder mit BRCA1- Mutationen wenig oder keinen Schutz vor Brustkrebs bieten und paradoxerweise das Brustkrebsrisiko für Frauen mit BRCA2- Mutationen erhöhen .
Körperliche Aktivität und die Aufrechterhaltung eines gesunden Körpergewichts beugt Brustkrebs und anderen Krebsarten in der allgemeinen Bevölkerung vor und beugt Herzerkrankungen und anderen Erkrankungen vor. Bei Frauen mit einer BRCA- Mutation hat körperliche Aktivität und ein gesundes Körpergewicht als Heranwachsende keinen Einfluss auf Eierstockkrebs und können Brustkrebs nach der Menopause verzögern, aber nicht vollständig verhindern. In einigen Studien brachte nur signifikantes, anstrengendes Training einen Nutzen. Übergewicht und Gewichtszunahme im Erwachsenenalter werden mit der Diagnose von Brustkrebs in Verbindung gebracht.
Studien zu bestimmten Lebensmitteln, Diäten oder Nahrungsergänzungsmitteln haben in der Regel widersprüchliche Informationen geliefert oder wurden im Fall von Nahrungsfetten , Sojakonsum und dem Trinken von grünem Tee nur bei Frauen mit mittlerem Risiko durchgeführt. Die einzige diätetische Intervention, die allgemein als Prävention von Brustkrebs bei Trägern der BRCA- Mutation akzeptiert wird , ist die Minimierung des Konsums alkoholischer Getränke . Der Konsum von mehr als einem alkoholischen Getränk pro Tag ist stark mit einem höheren Risiko verbunden, an Brustkrebs zu erkranken, und Trägern wird in der Regel empfohlen, nicht mehr als ein alkoholisches Getränk pro Tag und insgesamt nicht mehr als vier pro Woche zu sich zu nehmen.
In einer Studie mit aschkenasischen jüdischen Frauen wurde beobachtet, dass Mutationsträgerinnen, die vor 1940 geboren wurden, ein viel geringeres Risiko haben, im Alter von 50 Jahren an Brustkrebs zu erkranken, als nach 1940 geborene Mutationsträgerinnen; dies wurde auch in der Nicht-Trägerpopulation beobachtet. Die Gründe für den Unterschied sind unbekannt. Im Gegensatz zur allgemeinen Bevölkerung haben das Alter bei der Menarche und das Alter bei der Menopause keinen Einfluss auf das Brustkrebsrisiko für Träger von BRCA- Mutationen.
Evolutionärer Vorteil
Mehrere Hypothesen schlagen vor, dass BRCA- Mutationen evolutionäre Vorteile haben könnten, wie beispielsweise eine höhere Intelligenz. Die aschkenasische Intelligenzhypothese wurde von Gregory Cochran vorgeschlagen und behauptet, dass ein Defekt im BRCA1- Gen neuronales Wachstum auslösen könnte.
Studien haben gezeigt, dass BRCA1- Mutationen nicht zufällig sind, sondern unter adaptiver Selektion, was darauf hindeutet, dass BRCA1- Mutationen , obwohl sie mit Brustkrebs in Verbindung stehen, wahrscheinlich auch eine positive Wirkung haben.
Patente
Eine Patentanmeldung für das isolierte BRCA1- Gen und die oben diskutierten krebskrebsfördernden Mutationen sowie für Methoden zur Diagnose der Wahrscheinlichkeit, an Brustkrebs zu erkranken, wurde von der University of Utah, dem National Institute of Environmental Health Sciences (NIEHS) und Myriad Genetics eingereicht 1994; im nächsten Jahr in Zusammenarbeit mit Forschern aus Endo Recherche, Inc., HSC Research & Development Limited Partnership, und der University of Pennsylvania, isoliert und sequenziert , um die Myriad, BRCA2 - Gene und Schlüsselmutationen identifiziert und das erste BRCA2 Patent wurde in dem eingereichten US von Myriad und anderen Institutionen im Jahr 1995. Myriad ist der exklusive Lizenznehmer dieser Patente und hat sie in den USA gegen klinische Diagnoselabore durchgesetzt. Dieses Geschäftsmodell führte dazu, dass Myriad 1994 von einem Startup zu einem börsennotierten Unternehmen mit 1200 Mitarbeitern und einem Jahresumsatz von etwa 500 Millionen US-Dollar im Jahr 2012 heranwuchs; es führte auch zu Kontroversen über hohe Preise und die Unfähigkeit, Zweitmeinungen von anderen diagnostischen Labors einzuholen, was wiederum zu der wegweisenden Klage Association for Molecular Pathology v. Myriad Genetics führte . Die Patente laufen ab 2014.
In einem 2010 in der Zeitschrift Genetic Medicine veröffentlichten Artikel heißt es: „Die Patentgeschichte außerhalb der Vereinigten Staaten ist komplizierter … In Australien und Großbritannien erlaubte der Lizenznehmer von Myriad die Nutzung durch Gesundheitssysteme, kündigte jedoch im August 2008 eine Änderung der Pläne an Einspruchsverfahren. Tatsächlich sind die Vereinigten Staaten die einzige Gerichtsbarkeit, in der Myriads starke Patentposition den Status eines einzigen Anbieters verliehen hat." Peter Meldrum, CEO von Myriad Genetics, hat bestätigt, dass Myriad in Europa "andere Wettbewerbsvorteile hat, die eine solche [Patent-]Durchsetzung unnötig machen könnten".
Rechtliche Entscheidungen im Zusammenhang mit den BRCA1- und BRCA2- Patenten werden sich auf den Bereich der Gentests im Allgemeinen auswirken. Im Juni 2013 entschied der Oberste Gerichtshof der USA in der Association for Molecular Pathology v. Myriad Genetics (Nr. 12-398) einstimmig: "Ein natürlich vorkommendes DNA-Segment ist ein Naturprodukt und nicht patentfähig, nur weil es isoliert wurde". “, wodurch Myriads Patente auf die BRCA1- und BRCA2-Gene ungültig gemacht werden. Der Gerichtshof stellte jedoch auch fest, dass die Manipulation eines Gens, um etwas zu schaffen, das in der Natur nicht vorkommt, dennoch patentrechtlich geschützt werden kann.
Siehe auch
Verweise
Externe Links
- BOADICEA , ein Instrument zur Risikoabschätzung bei familiärem Brust- und Eierstockkrebs
- BRCA1 und BRCA2 bei Labortests Online
- BRCA Exchange , große Datenbank von BRCA1- und BRCA2-Varianten mit Pathogenitätsklassifikationen.
