Dikobaltoctacarbonyl - Dicobalt octacarbonyl

|
|
|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
Octacarbonyldicobalt ( Co-Co )
|
|
| Andere Namen
Kobaltcarbonyl, Di-mu-Carbonylhexacarbonyldicobalt, Kobaltoctacarbonyl, Kobalttetracarbonyldimer, Dikobaltcarbonyl, Octacarbonyldicobalt
|
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA-Infokarte |
100.030.454 |
| EG-Nummer | |
|
PubChem- CID
|
|
| RTECS-Nummer | |
| UNII | |
| UN-Nummer | 3281 |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| Co 2 (CO) 8 | |
| Molmasse | 341,95 g/mol |
| Aussehen | rot-orange Kristalle weißer kristalliner Feststoff in reinem Zustand |
| Dichte | 1,87 g / cm 3 |
| Schmelzpunkt | 51 bis 52 °C (124 bis 126 °F; 324 bis 325 K) |
| Siedepunkt | 52 °C (126 °F; 325 K) ca zersetzt sich |
| unlöslich | |
| Dampfdruck | 0,7 mmHg (20 °C) |
| Struktur | |
| 1,33 D (C 2v- Isomer) 0 D (D 3d- Isomer) |
|
| Gefahren | |
| Hauptgefahren | Sehr giftig, entwickelt bei Zersetzung CO-Gas, pyrophor, krebserregend |
| Sicherheitsdatenblatt | Externes Sicherheitsdatenblatt |
| GHS-Piktogramme |
   
|
| GHS-Signalwort | Achtung |
| H228 , H251 , H302 , H312 , H315 , H317 , H319 , H330 , H334 , H350 , H351 , H361 , H412 | |
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | Pyrophore |
| NIOSH (US-Grenzwerte für die Gesundheitsbelastung): | |
|
PEL (zulässig)
|
keiner |
|
REL (empfohlen)
|
TWA 0,1 mg/m 3 |
|
IDLH (unmittelbare Gefahr)
|
ND |
| Verwandte Verbindungen | |
|
Verwandte Metallcarbonyle
|
Eisenpentacarbonyl Dieisennonacarbonyl Nickeltetracarbonyl |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Dicobaltoctacarbonyl ist die metallorganische Verbindung mit der Zusammensetzung Co 2 (CO) 8 . Dieses Metallcarbonyl wird als Reagens und Katalysator in der metallorganischen Chemie und organischen Synthese verwendet und ist von zentraler Bedeutung für viele bekannte Organocobalt-Chemie . Es ist die Vorstufe eines Hydroformylierungskatalysators , Kobalttetracarbonylhydrid . Jedes Molekül besteht aus zwei Kobaltatomen , die an acht Kohlenmonoxidliganden gebunden sind , obwohl mehrere unterschiedliche strukturelle Anordnungen bekannt sind. Einige der Carbonylliganden sind hoch labil . Die Verbindung ist in hohem Maße reaktiv gegenüber Alkinen , und wird manchmal als Alkin eingesetzt Schutzgruppe . Als Cobalt-Alkin-Komplex spielt es eine Rolle bei der Förderung sowohl der Nicholas- als auch der Pauson-Khand-Reaktion .
Synthese, Struktur, Eigenschaften
Dicobaltoctacarbonyl ist ein weißer Feststoff, wenn er von hoher Reinheit ist, aber typischerweise ist er ein orangefarbener, pyrophorer Feststoff, der thermisch instabil ist. Es wird durch Hochdruck- Carbonylierung von Kobalt(II) -Salzen synthetisiert . Bei dem von James Eli Knap patentierten Verfahren wird Kobalt(II)-acetat auf 150 bis 200 °C erhitzt und Wasserstoff- und Kohlenmonoxidgasen bei Drücken von 2000 bis 6000 psi ausgesetzt :
- 2 Co(CH 3 CO 2 ) 2 + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
Die Herstellung wird oft in Gegenwart von Cyanid durchgeführt , wobei das Kobalt(II)-Salz in einen Hexacyanocobaltat(II)-Komplex umgewandelt wird, der dann mit Kohlenmonoxid behandelt wird, um K[Co(CO) 4 ] zu ergeben. Ansäuern erzeugt Kobalttetracarbonylhydrid , HCo(CO) 4 , das dann erhitzt werden kann, um Dikobaltoctacarbonyl zu bilden. Es kann auch durch Erhitzen von Kobaltmetall auf über 250 °C in einem Kohlenmonoxidgasstrom bei etwa 200 bis 300 atm hergestellt werden :
- 2 Co + 8 CO → Co 2 (CO) 8
Es ist bekannt, dass es in mehreren isomeren Formen existiert, alle mit der gleichen Zusammensetzung – [Co 2 (CO) 8 ] – mit zwei Cobalt-Metallzentren in der Oxidationsstufe Null, umgeben von acht Carbonyl(CO) -Liganden . Diese Liganden können eine Brücke zwischen den beiden Kobaltzentren bilden oder an ein einzelnes Metallzentrum (einen terminalen Liganden ) gebunden sein . In Lösung sind zwei Isomere bekannt, die sich schnell ineinander umwandeln:
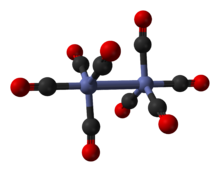
Das Hauptisomer (im obigen Gleichgewichtsprozess links ) enthält zwei verbrückende Carbonylliganden, die die Kobaltzentren verbinden, und sechs terminale Carbonylliganden, drei an jedem Metall. Es kann durch die Formel (CO) 3 Co(μ-CO) 2 Co(CO) 3 zusammengefasst werden und hat C 2v -Symmetrie . Diese Struktur ähnelt der von Dieisennonacarbonyl (Fe 2 (CO) 9 ), jedoch mit einem verbrückenden Carbonyl weniger. Der Co-Co-Abstand beträgt 2.52 , und die Co-CO- Terminal- und Co-CO- Brücken- Abstände betragen 1.80 bzw. 1.90 . Die Analyse der Bindung deutet auf das Fehlen einer direkten Kobalt-Kobalt-Bindung hin.
Das Nebenisomer hat keine verbrückenden Carbonylliganden, sondern hat stattdessen eine direkte Bindung zwischen den Kobaltzentren und acht terminalen Carbonylliganden, vier an jedem Metallatom. Es lässt sich durch die Formel (CO) 4 Co-Co(CO) 4 zusammenfassen und hat D 4d- Symmetrie. Es weist eine nicht überbrückte Kobalt-Kobalt-Bindung auf, die in der festen Struktur 2.70 Å lang ist, wenn es zusammen mit C 60 kristallisiert wird .
Reaktionen
Die Ermäßigung
Dicobaltoctacarbonyl wird durch Alkalimetalle und verwandte Reagenzien reduktiv gespalten. Die resultierenden Alkalimetallsalze protonieren zu Tetracarbonylcobalthydrid :
- Co 2 (CO) 8 + 2 Na → 2 NaCo(CO) 4
- NaCo(CO) 4 + H + → HCo(CO) 4 + Na +
Reaktionen mit Elektrophilen
Halogene und verwandte Reagenzien spalten die Co-Co-Bindung zu fünffach koordinierten Halogentetracarbonylen:
- Co 2 (CO) 8 + Br 2 → 2 BrCo(CO) 4
Kobalttricarbonylnitrosyl wird durch Behandlung von Dikobaltoctacarbonyl mit Stickstoffmonoxid hergestellt:
- Co 2 (CO) 8 + 2 NO → 2 Co(CO) 3 NO + 2 CO
Nikolaus-Reaktion
Die Nicholas-Reaktion ist eine Substitutionsreaktion, bei der eine Alkoxygruppe, die sich am α-Kohlenstoff eines Alkins befindet, durch ein anderes Nucleophil ersetzt wird . Das Alkin reagiert zuerst mit Dicobaltoctacarbonyl, von dem ein stabilisiertes erzeugt wird propargylische Kations daß reagiert mit dem eingehenden Nucleophil und das Produkt dann Formen durch oxidative Entmetallisierung .
Pauson-Khand-Reaktion
Die Pauson-Khand-Reaktion , bei der ein Alkin , ein Alken und Kohlenmonoxid zu einem Cyclopentenon cyclisieren , kann durch Co 2 (CO) 8 katalysiert werden , obwohl inzwischen neuere, effizientere Methoden entwickelt wurden:
Co 2 (CO) 8 reagiert mit Alkinen unter Bildung eines stabilen kovalenten Komplexes, der als Schutzgruppe für das Alkin nützlich ist . Dieser Komplex selbst kann auch in der Pauson-Khand-Reaktion verwendet werden.
Intramolekulare Pauson-Khand-Reaktionen, bei denen das Ausgangsmaterial sowohl die Alken- als auch die Alkin-Einheiten enthält, sind möglich. In der asymmetrischen Synthese des Lycopodium Alkaloid Huperzin-Q , Takayama et al verwendet eine intramolekulare Pauson-Khand Reaktion eine cyclisieren Enin enthaltend eine tert - Butyldiphenylsilyl (TBDPS) geschützten primären Alkohol. Die Herstellung der cyclischen Siloxaneinheit unmittelbar vor der Einführung des Dikobaltoctacarbonyls stellt sicher, dass das Produkt mit der gewünschten Konformation gebildet wird .

Schritt 1 : Dissoziation von Kohlenmonoxid von Kobalttetracarbonylhydrid zu HCo(CO) 3 , der aktiven katalytischen Spezies
Schritt 2 : Das Cobaltzentrum bildet eine π-Bindung zum Alken
Schritt 3 : Alkenligand inseriert in die Cobalt-Hydrid-Bindung
Schritt 4 : Koordination eines zusätzlichen Carbonylliganden
Schritt 5 : Migratorische Insertion eines Carbonylliganden in die Cobalt-Alkyl-Bindung, Umwandlung von das Alkyltetracarbonyl-Intermediat in eine Acyltricarbonyl-Spezies
Schritt 6 : Oxidative Addition von Wasserstoff führt zu einem Dihydrido-Komplex
Schritt 7 : Aldehydprodukt wird durch reduktive Eliminierung freigesetzt, wodurch die aktive katalytische Spezies regeneriert wird
Schritt 8 : Eine unproduktive und reversible Nebenreaktion
Hydroformylierung
Die Hydrierung von Co 2 (CO) 8 erzeugt Cobalttetracarbonylhydrid, [HCo(CO) 4 ]:
- Co 2 (CO) 8 + H 2 → 2 HCo(CO) 4
Dieses Hydrid wird als Katalysator für die Hydroformylierung verwendet – die Umwandlung eines endständigen Alkens , RCH=CH 2 , in einen Aldehyd , RCH 2 CH 2 CHO. Der Katalysezyklus für diese Hydroformylierung ist im Diagramm dargestellt.
Die Reduktion von Co 2 (CO) 8 mit Natriumamalgam ergibt die konjugierte Base von HCo(CO) 4 . Dieses Salz liefert beim Ansäuern das Hydrid und bietet einen alternativen Syntheseweg zu dieser Spezies. Salze dieser Form sind auch Zwischenprodukte im Cyanid-Syntheseweg für Dicobaltoctacarbonyl.
- Co 2 (CO) 8 + 2 Na → 2 NaCo(CO) 4
- NaCo(CO) 4 + H + → HCo(CO) 4 + Na +
Die CO-Liganden können durch tertiäre Phosphinliganden ersetzt werden , um Co 2 (CO) 8− x (PR 3 ) x zu ergeben . Diese sperrigen Derivate sind selektivere Katalysatoren für Hydroformylierungsreaktionen. " Harte " Lewis - Basen , zB Pyridin , führen zu Disproportionierungen :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co(C 5 H 5 N) 6 ][Co(CO) 4 ] 2 + 8 CO

Tricobalt-Nonacarbonyle
Erhitzen verursacht Decarbonylierung und Bildung von Tetracobaltdodecacarbonyl :
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Wie viele Metallcarbonyle abstrahiert Dicobaltoctacarbonyl Halogenide von Alkylhalogeniden. Bei der Reaktion mit Bromoform , wandelt es in methylidynetricobaltnonacarbonyl , HCCO 3 (CO) 9 , das durch eine Reaktion , die als idealisiert werden kann:
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
Die röntgenkristallographische Analyse zeigt, dass das Produkt ein Dreieck von Cobaltatomen in Abständen von nahe 2.48 enthält, die jeweils an drei terminale Carbonylgruppen gebunden sind und wobei eine Methylidin (CH)-Gruppe die Spitze einer dreieckigen Pyramide bildet. Dieses Produkt ist strukturell mit Tetracobaltdodecacarbonyl verwandt, theoretisch durch Ersetzen der Methylidingruppe durch eine vierte Co(CO) 3 -Einheit . Es gab jedoch Unstimmigkeiten zwischen Theorie und Experiment, da gezeigt wurde, dass die tatsächliche Struktur von Tetracobaltdodecacarbonyl drei verbrückende Carbonylgruppen aufweist.
Sicherheit
Co 2 (CO) 8 ist eine flüchtige Quelle von Cobalt(0), ist pyrophor und setzt bei der Zersetzung Kohlenmonoxid frei . Das Nationale Institut für Sicherheit und Gesundheitsschutz am Arbeitsplatz hat empfohlen, dass Arbeitnehmer ohne geeignete Atemschutzausrüstung keinen Konzentrationen von mehr als 0,1 mg/m 3 über einen achtstündigen zeitgewichteten Durchschnitt ausgesetzt werden sollten .
Verweise
- ^ a b c d e f g h NIOSH Pocket Guide to Chemical Hazards. "#0147" . Nationales Institut für Arbeitssicherheit und Gesundheitsschutz (NIOSH).
- ^ a b Pauson, Peter L. ; Stambuli, James P.; Chou, Teh-Chang; Hong, Bor-Cherng (2014). "Octacarbonyldicobalt". Enzyklopädie der Reagenzien für die organische Synthese . John Wiley & Söhne . doi : 10.1002/047084289X.ro001.pub3 .
- ^ a b c d e f g h i j Donaldson, John Dallas; Beyersmann, Detmar (2005). „Kobalt und Kobaltverbindungen“. Ullmanns Enzyklopädie der Technischen Chemie . Wiley-VCH. doi : 10.1002/14356007.a07_281.pub2 .
- ^ a b c d Elschenbroich, C.; Salzer, A. (1992). Organometallics: Eine kurze Einführung (2. Aufl.). Weinheim: Wiley-VCH . ISBN 3-527-28165-7.
- ^ a b c d Sweany, Ray L.; Brown, Theodore L. (1977). „Infrarotspektren von Matrix-isoliertem Dicobaltoctacarbonyl. Beweis für das dritte Isomer“. Anorganische Chemie . 16 (2): 415–421. doi : 10.1021/ic50168a037 .
- ^ a b c Nicholas, Kenneth M. (1987). „Chemie und synthetischer Nutzen von Kobalt-komplexierten Propargylkationen“. Gem. Chem.-Nr. Res. (Rezension). 20 (6): 207–214. doi : 10.1021/ar00138a001 .
- ^ a b c Teobald, Barry J. (2002). „Die Nicholas-Reaktion: Die Verwendung von Dicobalt-Hexacarbonyl-stabilisierten Propargyl-Kationen in der Synthese“. Tetraeder (Rezension). 58 (21): 4133–4170. doi : 10.1016/S0040-4020(02)00315-0 .
- ^ a b c Pauson, PL ; Khand, IU (1977). „Verwendungen von Kobalt-Carbonyl-Acetylen-Komplexen in der organischen Synthese“. Ann. NY Akad. Wissenschaft 295 (1): 2–14. doi : 10.1111/j.1749-6632.1977.tb41819.x .
- ^ a b Blanco-Urgoiti, Jaime; Añorbe, Loreto; Pérez-Serrano, Leticia; Domínguez, Gema; Pérez-Castells, Javier (2004). „Die Pauson-Khand-Reaktion, ein leistungsfähiges synthetisches Werkzeug für die Synthese komplexer Moleküle“. Chem.-Nr. Soz. Offb. 33 (1): 32–42. doi : 10.1039/b300976a .
- ^ US-Patent 3236597 , Knap, James Eli, "High-Purity Dicobalt Octacarbonyl", erteilt am 22. Februar 1966, übertragen auf die Union Carbide Corporation
- ^ a b Orchin, Milton (1953). „Hydrierung organischer Verbindungen mit Synthesegas“. Fortschritte in der Katalyse . 5 . Akademische Presse . S. 385–415. ISBN 9780080565095.
- ^ Sumner, G. Gardner; Klug, Harold P.; Alexander, Leroy E. (1964). „Die Kristallstruktur von Dicobaltoctacarbonyl“. Acta Crystallographica . 17 (6): 732–742. doi : 10.1107/S0365110X64001803 .
- ^ Grün, Jennifer C.; Grün, Malcolm LH ; Parkin, Gerard (2012). „Das Auftreten und die Darstellung von Drei-Zentrum-Zwei-Elektronen-Bindungen in kovalenten anorganischen Verbindungen“. Chemische Kommunikation . 2012 (94): 11481-11503. doi : 10.1039/c2cc35304k .
- ^ Garcia, Thelma Y.; Fettinger, James C.; Olmstead, Marilyn M.; Balch, Alan L. (2009). „Herrliche Symmetrie: Kristallisation eines unverbrückten Isomers von Co 2 (CO) 8 in Co 2 (CO) 8 · C 60 “. Chemische Kommunikation . 2009 (46): 7143–7145. doi : 10.1039/b915083h .
- ^ Lockwood, Rosa F.; Nicholas, Kenneth M. (1977). „Übergangsmetall-stabilisierte Carbeniumionen als synthetische Zwischenprodukte. I. α-[(Alkinyl)dicobalthexacarbonyl]carbeniumionen als Propargylierungsmittel“. Tetraeder Lett. 18 (48): 4163–4165. doi : 10.1016/S0040-4039(01)83455-9 .
- ^ Nikolaus, KM; Pettit, R. (1972). „Über die Stabilität von α-(Alkinyl)dicobalt-Hexacarbonyl-Carbonium-Ionen“. J. Organomet. Chem.-Nr. 44 (1): C21–C24. doi : 10.1016/0022-328X(72)80037-8 .
- ^ Schore, Neil E. (1991). „Die Pauson-Khand-Cycloadditionsreaktion zur Synthese von Cyclopentenonen“. Org. Reagieren. 40 : 1. doi : 10.1002/0471264180.or040.01 .
- ^ Gibson, Susan E.; Stevenazzi, Andrea (2003). "Die Pauson-Khand-Reaktion: Das katalytische Zeitalter ist da!". Angew. Chem.-Nr. Int. Hrsg. 42 (16): 1800-1810. doi : 10.1002/ange.200200547 .
- ^ Nakayama, Atsushi; Kogure, Noriyuki; Kitajima, Mariko; Takayama, Hiromitsu (2011). „Asymmetrische Totalsynthese eines pentacyclischen Lycopodium- Alkaloids: Huperzine-Q“. Angew. Chem.-Nr. Int. Hrsg. 50 (35): 8025–8028. doi : 10.1002/ange.201103550 .
- ^ Ho, Tse-Lok (2016). "Dikobalt-Octacarbonyl" . Fiesers' Reagenzien für die organische Synthese . 28 . John Wiley & Söhne . S. 251–252. ISBN 9781118942819.
- ^ a b Heck, Richard F. ; Breslow, David S. (1961). „Die Reaktion von Cobalt Hydrotetracarbonyl mit Olefinen“. Zeitschrift der American Chemical Society . 83 (19): 4023–4027. doi : 10.1021/ja01480a017 .
- ^ a b Halpern, Jack (2001). "Metallorganische Chemie an der Schwelle zum neuen Jahrtausend. Rückblick und Ausblick" . Reine und Angewandte Chemie . 73 (2): 209–220. doi : 10.1351/pac200173020209 .
- ^ a b Pfeffer, M.; Grellier, M. (2007). „Kobalt-Organometallics“. Umfassende metallorganische Chemie III . 7 . Sonst . S. 1–119. doi : 10.1016/B0-08-045047-4/00096-0 .
- ^ Chini, S. (1968). „Die geschlossenen Metall-Carbonyl-Cluster“. Bewertungen für Inorganica Chimica Acta . 2 : 31–51. doi : 10.1016/0073-8085(68)80013-0 .
- ^ Nestle, Mara O.; Hallgren, John E.; Seyferth, Dietmar; Dawson, Peter; Robinson, Brian H. (1980). „μ 3 -Methylidin und μ 3 -Benzylidin-Tris(Tricarbonylcobalt)“. Inorg. Synth. 20 : 226–229. doi : 10.1002/9780470132517.ch53 .
- ^ Leung, S.; Coppens, P.; McMullan, RK; Kötzle, TF (1981). „Die Struktur von Nonacarbonyl-μ 3 -methylidin- triangulo- tricobalt. Röntgen- und Neutronenbeugungsstudien“. Acta Crystallogr. B. . 37 (7): 1347-1352. doi : 10.1107/S0567740881005906 .
- ^ Corradini, Paolo (1959). „Struktur von Tetracobaltdodecarbonyl“. Zeitschrift für Chemische Physik . 31 (6): 1676–1677. doi : 10.1063/1.1730674 .
- ^ Wei, Chin Hsuan (1969). „Strukturanalysen von Tetracobalt-Dodecacarbonyl und Tetrarhodium-Dodecacarbonyl. Kristallographische Behandlungen einer ungeordneten Struktur und eines Zwillingsverbunds“. Anorganische Chemie . 8 (11): 2384–2397. doi : 10.1021/ic50081a030 .
- ^ Farrugia, Louis J.; Braga, Dario; Grepioni, Fabrizia (1999). „Eine Strukturneubestimmung von Co 4 (CO) 12 : Beweise für dynamische Unordnung und den Weg der Metallatommigration in der kristallinen Phase“. Zeitschrift für Organometallische Chemie . 573 (1–2): 60–66. doi : 10.1016/S0022-328X(98)00879-1 .
- ^ Cole Parmer SDB
- ^ CDC - NIOSH Pocket Guide to Chemical Hazards





