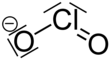
Natriumchlorit - Sodium chlorite
|
|
|||
|
|
|||

|
|||
| Namen | |||
|---|---|---|---|
|
IUPAC-Name
Natriumchlorit
|
|||
| Andere Namen
Chlorige Säure, Natriumsalz
Textone |
|||
| Identifikatoren | |||
|
3D-Modell ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA-InfoCard |
100.028.842 |
||
| EG-Nummer | |||
| KEGG | |||
|
PubChem- CID
|
|||
| RTECS-Nummer | |||
| UNII | |||
| UN-Nummer | 1496 | ||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| NaClO 2 | |||
| Molmasse | 90,442 g/mol (wasserfrei) 144,487 g/mol (Trihydrat) |
||
| Aussehen | weißer Feststoff | ||
| Geruch | geruchlos | ||
| Dichte | 2,468 g/cm 3 , fest | ||
| Schmelzpunkt | wasserfrei zersetzt sich bei 180–200 °C Trihydrat zersetzt sich bei 38 °C |
||
| 75,8 g/100 ml (25 °C) 122 g/100 ml (60 °C) |
|||
| Löslichkeit | leicht löslich in Methanol , Ethanol | ||
| Säure (p K a ) | 10-11 | ||
| Struktur | |||
| monoklin | |||
| Thermochemie | |||
|
Std
Bildungsenthalpie (Δ f H ⦵ 298 ) |
-307,0 kJ/mol | ||
| Pharmakologie | |||
| D03AX11 ( WER ) | |||
| Gefahren | |||
| Sicherheitsdatenblatt | SDB | ||
| GHS-Piktogramme |
   
|
||
| GHS-Signalwort | Achtung | ||
| H272 , H301 , H310 , H330 , H314 , H318 , H400 | |||
| P210 , P220 , P221 , P260 , P262 , P264 , P270 , P271 , P273 , P280 , P284 , P301+330+331 , P303+361+353 , P305+351+338 , P310 , P361 , P363 , P370+378 , P391 , P403+233 , P405 , P501 | |||
| Verschlucken Gefahr | Kategorie 3 | ||
| Inhalationsgefahr | Kategorie 2 | ||
| Augengefahr | Kategorie 1 | ||
| Haut Gefahr | Kategorie 1B | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | Nicht brennbar | ||
| Letale Dosis oder Konzentration (LD, LC): | |||
|
LD 50 ( mediane Dosis )
|
350 mg/kg (Ratte, oral) | ||
| Verwandte Verbindungen | |||
|
Andere Anionen
|
Natriumchlorid Natriumhypochlorit Natriumchlorat Natriumperchlorat |
||
|
Andere Kationen
|
Kaliumchlorit Bariumchlorit |
||
|
Verwandte Verbindungen
|
Chlordioxid Chlorsäure |
||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Natriumchlorit (NaClO 2 ) ist eine chemische Verbindung, die bei der Papierherstellung und als Desinfektionsmittel verwendet wird .
Verwenden
Die Hauptanwendung von Natriumchlorit ist die Erzeugung von Chlordioxid zum Bleichen und Strippen von Textilien , Zellstoff und Papier. Es wird auch zur Desinfektion von kommunalen Wasseraufbereitungsanlagen nach der Umstellung auf Chlordioxid verwendet. Ein Vorteil bei dieser Anwendung im Vergleich zu dem häufiger verwendeten Chlor besteht darin, dass Trihalogenmethane (wie Chloroform ) nicht aus organischen Verunreinigungen hergestellt werden. Aus Natriumchlorit erzeugtes Chlordioxid ist von der FDA unter bestimmten Bedingungen zur Desinfektion von Wasser zum Waschen von Obst, Gemüse und Geflügel zugelassen.
Natriumchlorit, NaClO 2 , manchmal in Kombination mit Zinkchlorid , findet auch Anwendung als Bestandteil in therapeutischen Spülungen, Mundwässern, Zahnpasten und -gelen, Mundsprays, als Konservierungsmittel in Augentropfen und in Kontaktlinsen-Reinigungslösungen unter dem Handelsnamen Purite.
Es wird auch zum Desinfizieren von Luftkanälen und HVAC/R-Systemen und Tierauffangbereichen (Wände, Böden und andere Oberflächen) verwendet.
Chemisches Reagenz
In der organischen Synthese wird Natriumchlorit häufig als Reagens bei der Pinnick-Oxidation zur Oxidation von Aldehyden zu Carbonsäuren verwendet . Die Reaktion wird normalerweise in einer mit Mononatriumphosphat gepufferten Lösung in Gegenwart eines Chlorfängers (normalerweise 2-Methyl-2-buten ) durchgeführt.
2005 wurde Natriumchlorit als Oxidationsmittel verwendet, um Alkylfurane in einer einfachen Eintopfsynthese in die entsprechenden 4-Oxo-2-alkensäuren umzuwandeln.
Angesäuertes Natriumchlorit
Das Mischen von Natriumchloritlösung mit einer schwachen Säurelösung in Lebensmittelqualität (üblicherweise Zitronensäure ), die beide stabil sind, erzeugt kurzlebiges angesäuertes Natriumchlorit (ASC), das starke dekontaminierende Eigenschaften hat. Beim Mischen des Hauptwirkstoffs entsteht chlorige Säure im Gleichgewicht mit Chloritanion. Der Anteil variiert mit pH, Temperatur und anderen Faktoren und reicht von ungefähr 5–35 % chloriger Säure mit 65–95 % Chlorit ; saurere Lösungen führen zu einem höheren Anteil an chloriger Säure. Chlorige Säure zerfällt zu Chlordioxid, das wiederum in Chloritanion und schließlich Chloridanion zerfällt. ASC wird zur Desinfektion von harten Oberflächen, die mit Lebensmitteln in Kontakt kommen, und zum Waschen oder Spülen einer Vielzahl von Lebensmitteln wie rotem Fleisch, Geflügel, Meeresfrüchten, Obst und Gemüse verwendet. Da die Oxo-Chlor-Verbindungen bei sachgemäßer Zubereitung instabil sind, sollten bei entsprechender Behandlung keine messbaren Rückstände auf Lebensmitteln vorhanden sein. ASC wird auch als Zitzenbad zur Kontrolle von Mastitis bei Milchkühen verwendet .
Einsatz in öffentlichen Krisen
Das US Army Natick Soldier Research, Development and Engineering Center produzierte eine tragbare Methode zur Erzeugung von Chlordioxid, die als ClO 2 bekannt ist und als eines der besten verfügbaren Biozide zur Bekämpfung von Verunreinigungen, die von harmlosen Mikroben reichen , beschrieben wird und Lebensmittelpathogene der Kategorie A Bioterror - Agenten. In den Wochen nach den Anschlägen vom 11. September 2001, als Milzbrand in Briefen an Beamte verschickt wurde, verwendeten Gefahrstoffteams ClO 2 , um das Bürogebäude des Senats von Hart und die Poststation Brentwood zu dekontaminieren.
Zur Bekämpfung der COVID-19-Pandemie hat die US-Umweltschutzbehörde eine Liste mit vielen Desinfektionsmitteln veröffentlicht , die ihre Kriterien für den Einsatz bei Umweltmaßnahmen gegen das verursachende Coronavirus erfüllen . Einige basieren auf Natriumchlorit, das zu Chlordioxid aktiviert wird , obwohl in jedem Produkt unterschiedliche Formulierungen verwendet werden. Viele andere Produkte auf der EPA-Liste enthalten Natriumhypochlorit , das im Namen ähnlich ist, aber nicht mit Natriumchlorit verwechselt werden sollte, da sie sehr unterschiedliche chemische Wirkungsweisen haben.
Sicherheit
Natriumchlorit sollte, wie viele Oxidationsmittel , vor unbeabsichtigter Kontamination durch organische Materialien geschützt werden, um die Bildung eines explosiven Gemisches zu vermeiden. Die Chemikalie ist in reiner Form stabil und explodiert nicht bei einem Schlag, es sei denn, es sind organische Verunreinigungen vorhanden, wie zum Beispiel bei einem fettigen Hammer, der die Chemikalie auf einen Amboss schlägt. Es entzündet sich auch leicht durch Reibung, wenn es mit einem Reduktionsmittel wie Puderzucker, Schwefel oder rotem Phosphor kombiniert wird .
Toxizität
Natriumchlorit ist ein starkes Oxidationsmittel und kann daher ähnliche klinische Symptome wie das bekannte Natriumchlorat verursachen : Methämoglobinämie , Hämolyse , Nierenversagen . Eine Dosis von 10-15 Gramm Natriumchlorat kann tödlich sein. Bei Ratten und Katzen wurde Methämoglobämie nachgewiesen, und neuere Studien der EMEA haben bestätigt, dass die klinische Symptomatik der von Natriumchlorat bei Ratten, Mäusen, Kaninchen und grünen Meerkatzen verursachten sehr ähnlich ist .
Es gibt nur einen Fall beim Menschen in der medizinischen Literatur von Chlorit - Vergiftung. Es scheint zu bestätigen, dass die Toxizität der von Natriumchlorat entspricht . Nach der Analogie mit Natriumchlorat, auch kleine Mengen von etwa 1 Gramm kann Ursache zu erwarten Übelkeit , Erbrechen und sogar lebensbedrohliche Hämolyse in Glucose-6-Phosphat - Dehydrogenase - defizienten Personen.
Die EPA hat einen maximalen Schadstoffgehalt von 1 Milligramm Chlorit pro Liter (1 mg/L) im Trinkwasser festgelegt.
Verkäufer von " Miracle Mineral Solution ", einer Mischung aus Natriumchlorit und Zitronensäure, auch bekannt als "MMS", die als Allheilmittel beworben wird , wurden in mehreren Gerichtsbarkeiten auf der ganzen Welt verurteilt, mit Geldstrafen belegt oder anderweitig diszipliniert. MMS-Produkte wurden verschiedentlich als Schlangenöl und komplette Quacksalberei bezeichnet . Die US-amerikanische Food and Drug Administration hat mehrfach vor dem Konsum von MMS gewarnt.
Herstellung
Die freie Säure, chlorige Säure , HClO 2 , ist nur bei geringen Konzentrationen stabil. Da es nicht konzentriert werden kann, ist es kein Handelsprodukt. Das entsprechende Natriumsalz, Natriumchlorit, NaClO 2 ist jedoch stabil und kostengünstig genug, um kommerziell erhältlich zu sein. Die entsprechenden Salze von Schwermetallen (Ag + , Hg + , Tl + , Pb 2+ , sowie Cu 2+ und NH 4 + ) zersetzen sich unter Hitze oder Schock explosionsartig.
Natriumchlorit wird indirekt von Natriumchlorat , NaClO 3 abgeleitet . Zuerst wird Natriumchlorat zu einem reduzierten Chlordioxid , typischerweise in einer starken sauren Lösung unter Verwendung von Mitteln, wie Reduktions Natriumsulfit , Schwefeldioxid oder Salzsäure . Dieses Zwischenprodukt wird dann in eine Lösung von wässrigem Natriumhydroxid absorbiert, wo ein anderes Reduktionsmittel es in Natriumchlorit umwandelt. Sogar Wasserstoffperoxid kann als Reduktionsmittel verwendet werden, wodurch Sauerstoffgas als Nebenprodukt entsteht und nicht andere anorganische Salze oder Materialien, die das gewünschte Produkt verunreinigen könnten.
Allgemeine Referenzen
- "Chemie der Elemente", NN Greenwood und A. Earnshaw, Pergamon Press, 1984.
- "Kirk-Othmer Concise Encyclopedia of Chemistry", Martin Grayson, Herausgeber, John Wiley & Sons, Inc., 1985