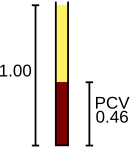Komplettes Blutbild - Complete blood count
| Komplettes Blutbild | |
|---|---|
 Eine CBC-Probe vor einem Ausdruck mit CBC- und Differentialergebnissen
| |
| Synonyme | Vollständiges Blutbild, Vollblutbild (FBC), Vollblutuntersuchung (FBE), Hämogramm |
| Gittergewebe | D001772 |
| MedlinePlus | 003642 |
| LOINC | Codes für CBC , z. B. 57021-8 |
| HCPCS-L2 | G0306 |
Ein vollständiges Blutbild ( CBC ), auch als volles Blutbild ( FBC ) bezeichnet, ist eine Reihe von medizinischen Labortests , die Informationen über die Zellen im Blut einer Person liefern . Die CBC gibt die Mengen an weißen Blutkörperchen , roten Blutkörperchen und Blutplättchen , die Konzentration an Hämoglobin und den Hämatokrit (den Volumenprozentsatz der roten Blutkörperchen) an. Die roten Blutkörperchen Indizes , die die durchschnittliche Größe und Hämoglobingehalt der roten Blutkörperchen zeigen, sind auch berichtet, und ein weißer Blutkörperchen Differential , die die verschiedenen Arten von weißen Blutkörperchen zählt, enthalten sein.
Die CBC wird häufig im Rahmen einer medizinischen Beurteilung durchgeführt und kann zur Überwachung des Gesundheitszustands oder zur Diagnose von Krankheiten verwendet werden. Die Ergebnisse werden interpretiert, indem sie mit Referenzbereichen verglichen werden , die je nach Geschlecht und Alter variieren. Zustände wie Anämie und Thrombozytopenie werden durch abnormale vollständige Blutbildergebnisse definiert. Die Indizes für rote Blutkörperchen können Informationen über die Ursache der Anämie einer Person wie Eisenmangel und Vitamin B12-Mangel liefern, und die Ergebnisse des Differentials der weißen Blutkörperchen können bei der Diagnose von viralen , bakteriellen und parasitären Infektionen und Bluterkrankungen wie Leukämie hilfreich sein . Nicht alle Ergebnisse, die außerhalb des Referenzbereichs liegen, erfordern einen medizinischen Eingriff.
Die CBC wird mit grundlegenden Laborgeräten oder einem automatisierten Hämatologieanalysator durchgeführt , der rote und weiße Blutkörperchen und Blutplättchen zählt und Informationen über deren Größe und Struktur sammelt. Die Hämoglobinkonzentration wird gemessen, und die Indizes der roten Blutkörperchen werden aus Messungen der roten Blutkörperchen und des Hämoglobins berechnet. Manuelle Tests können verwendet werden, um abnormale Ergebnisse unabhängig zu bestätigen. Ungefähr 10–25% der Proben erfordern eine manuelle Überprüfung des Blutausstrichs , bei der das Blut gefärbt und unter einem Mikroskop betrachtet wird , um zu überprüfen, ob die Ergebnisse des Analysegeräts mit dem Erscheinungsbild der Zellen übereinstimmen, und um nach Anomalien zu suchen. Der Hämatokrit kann manuell durch Zentrifugieren der Probe und Messen des Anteils roter Blutkörperchen bestimmt werden. In Labors ohne Zugang zu automatisierten Instrumenten werden die Blutkörperchen unter Verwendung eines Hämozytometers unter dem Mikroskop gezählt .
Karl Vierordt führte 1852 das erste Blutbild durch, indem er ein bestimmtes Blutvolumen auf einem Objektträger verteilte und die Zellen zählte. Die Erfindung des Hämozytometers im Jahr 1874 durch Louis-Charles Malassez vereinfachte die mikroskopische Analyse von Blutzellen, und im späten 19. Jahrhundert entwickelten Paul Ehrlich und Dmitri Leonidovich Romanowsky Methoden zur Färbung weißer und roter Blutkörperchen, die noch immer zur Untersuchung von Blutausstrichen verwendet werden . In den 1920er Jahren wurden automatisierte Methoden zur Messung von Hämoglobin entwickelt, und Maxwell Wintrobe führte 1929 die Hämatokritmethode von Wintrobe ein, mit der er wiederum die Indizes der roten Blutkörperchen definieren konnte. Ein Meilenstein in der Automatisierung der Blutzellzahl war das Coulter-Prinzip , das 1953 von Wallace H. Coulter patentiert wurde . Das Prinzip beinhaltet die Verwendung elektrischer Impedanzmessungen zur Zählung von Blutzellen und zur Messung ihrer Größe, eine Technologie, die in vielen automatisierten Zellen weiterhin verwendet wird Analysatoren. Weitere Forschungen in den 1970er Jahren umfassten die Verwendung optischer Messungen zum Zählen und Identifizieren von Zellen, was die Automatisierung des Differentials der weißen Blutkörperchen ermöglichte.
Zweck

Das vollständige Blutbild liefert Informationen über die drei zellulären Bestandteile des Blutes - rote Blutkörperchen , weiße Blutkörperchen und Blutplättchen . Einige Erkrankungen wie Anämie oder Thrombozytopenie sind durch eine deutliche Zunahme oder Abnahme der vollständigen Blutbildparameter definiert. Änderungen in vielen Organsystemen können sich auf das Blut auswirken. Daher sind CBC-Ergebnisse nützlich, um eine Vielzahl von Erkrankungen zu untersuchen. Aufgrund der Menge an Informationen ist das vollständige Blutbild einer der am häufigsten durchgeführten medizinischen Labortests .
Die CBC wird oft verwendet Bildschirm für Krankheiten im Rahmen einer medizinischen Untersuchung. Es ist auch erforderlich, wenn ein Gesundheitsdienstleister den Verdacht hat, dass eine Person eine Krankheit hat, die Blutzellen betrifft, wie z. B. eine Infektion , eine Blutungsstörung oder einige Krebsarten . Bei Personen, bei denen Störungen diagnostiziert wurden, die zu abnormalen CBC-Ergebnissen führen können, oder die Behandlungen erhalten, die das Blutbild beeinflussen können, wird möglicherweise eine regelmäßige CBC durchgeführt, um ihre Gesundheit zu überwachen. Der Test wird häufig täglich bei Personen durchgeführt, die in ein Krankenhaus eingeliefert werden. Die Ergebnisse können auf die Notwendigkeit einer Blut- oder Blutplättchentransfusion hinweisen .
Das vollständige Blutbild hat spezifische Anwendungen in vielen medizinischen Fachgebieten . Es wird häufig durchgeführt, bevor eine Person operiert wird , um eine Anämie zu erkennen, sicherzustellen, dass die Thrombozytenwerte ausreichend sind, und um nach Infektionen zu suchen, sowie nach der Operation, damit der Blutverlust überwacht werden kann. In der Notfallmedizin wird das CBC verwendet, um zahlreiche Symptome wie Fieber , Bauchschmerzen und Atemnot zu untersuchen und Blutungen und Traumata zu bewerten . Das Blutbild wird bei Personen, die sich einer Chemotherapie oder Strahlentherapie gegen Krebs unterziehen, engmaschig überwacht , da diese Behandlungen die Produktion von Blutzellen im Knochenmark unterdrücken und sehr niedrige Werte an weißen Blutkörperchen, Blutplättchen und Hämoglobin produzieren können . Regelmäßige CBCs sind für Personen erforderlich, die einige Psychopharmaka wie Clozapin und Carbamazepin einnehmen , was in seltenen Fällen zu einem lebensbedrohlichen Rückgang der Anzahl weißer Blutkörperchen führen kann ( Agranulozytose ). Da Anämie während der Schwangerschaft in schlechteren Ergebnissen für die Mutter und ihrem Baby führen kann, das Blutbild ist ein normaler Bestandteil der Schwangerschaftsvorsorge ; und bei Neugeborenen kann eine CBC erforderlich sein, um Gelbsucht zu untersuchen oder die Anzahl unreifer Zellen im Differential der weißen Blutkörperchen zu zählen , was ein Indikator für Sepsis sein kann .
Das vollständige Blutbild ist ein wesentliches Instrument der Hämatologie , dh die Untersuchung der Ursache, Prognose, Behandlung und Prävention von blutbedingten Krankheiten. Die Ergebnisse der CBC- und Abstrichuntersuchung spiegeln die Funktionsweise des hämatopoetischen Systems wider - der Organe und Gewebe, die an der Produktion und Entwicklung von Blutzellen beteiligt sind, wie Knochenmark, Lymphknoten , Thymus und Milz . Beispielsweise kann eine geringe Anzahl aller drei Zelltypen ( Panzytopenie ) darauf hinweisen, dass die Blutzellenproduktion durch eine Erkrankung des Knochenmarks beeinträchtigt wird, und eine Knochenmarkuntersuchung kann die Ursache weiter untersuchen. Abnormale Zellen auf dem Blutausstrich können auf eine akute Leukämie oder ein Lymphom hinweisen , während eine ungewöhnlich hohe Anzahl von Neutrophilen oder Lymphozyten in Kombination mit den Symptomen und Blutausstrichbefunden einer Person den Verdacht auf eine myeloproliferative Störung oder eine lymphoproliferative Störung erwecken kann . Die Untersuchung der CBC-Ergebnisse und des Blutausstrichs kann dazu beitragen, zwischen Ursachen für Anämie wie Ernährungsdefiziten , Knochenmarkstörungen , erworbenen hämolytischen Anämien und Erbkrankheiten wie Sichelzellenanämie und Thalassämie zu unterscheiden .
Die Referenzbereiche für das gesamte Blutbild repräsentieren den Bereich der Ergebnisse, die bei 95% der scheinbar gesunden Menschen gefunden wurden. Per Definition liegen 5% der Ergebnisse immer außerhalb dieses Bereichs, sodass einige abnormale Ergebnisse möglicherweise natürliche Abweichungen widerspiegeln, anstatt ein medizinisches Problem anzuzeigen. Dies ist besonders wahrscheinlich, wenn solche Ergebnisse nur geringfügig außerhalb des Referenzbereichs liegen, wenn sie mit den vorherigen Ergebnissen der Person übereinstimmen oder wenn keine anderen damit verbundenen Anomalien in der CBC vorliegen. Wenn der Test an einer relativ gesunden Bevölkerung durchgeführt wird, kann die Anzahl der klinisch unbedeutenden Anomalien die Anzahl der Ergebnisse überschreiten, die eine Krankheit darstellen. Die US Centers for Disease Control and Prevention und Preventive Services Task Force US wird nicht empfohlen , die CBC mit für bei gesunden Erwachsenen Screening , die nicht schwanger sind, und Berufsverbände in den Vereinigten Staaten, Großbritannien und Kanada empfehlen gegen präoperativen CBC - Tests für Operationen mit geringem Risiko bei Personen ohne relevante Erkrankungen. Wiederholte Blutentnahmen für CBC-Tests bei Krankenhauspatienten können zu einer im Krankenhaus erworbenen Anämie beitragen und zu unnötigen Transfusionen führen.
Verfahren
Die Probe wird gesammelt, indem Blut in ein Röhrchen gezogen wird, das ein Antikoagulans - typischerweise EDTA - enthält, um seine natürliche Gerinnung zu stoppen . Das Blut wird normalerweise aus einer Vene entnommen , aber wenn dies schwierig ist, kann es mit einem Fingerstick oder einem Fersenstich bei Babys aus den Kapillaren entnommen werden . Die Tests werden normalerweise mit einem automatisierten Analysegerät durchgeführt, aber manuelle Techniken wie eine Blutausstrichuntersuchung oder ein manueller Hämatokrit-Test können verwendet werden, um abnormale Ergebnisse zu untersuchen. Zellzählungen und Hämoglobinmessungen werden manuell in Labors durchgeführt, die keinen Zugang zu automatisierten Instrumenten haben.
Automatisiert
An Bord des Analysegeräts wird die Probe gerührt, um die Zellen gleichmäßig zu verteilen, dann verdünnt und in mindestens zwei Kanäle aufgeteilt, von denen einer zur Zählung der roten Blutkörperchen und Blutplättchen und der andere zur Zählung der weißen Blutkörperchen und zur Bestimmung der Hämoglobinkonzentration verwendet wird . Einige Instrumente messen Hämoglobin in einem separaten Kanal, und zusätzliche Kanäle können für unterschiedliche Leukozytenzahlen und spezielle Messungen von Blutplättchen verwendet werden. Die Zellen werden in einem Flüssigkeitsstrom suspendiert und ihre Eigenschaften werden gemessen, wenn sie in einer als Durchflusszytometrie bekannten Technik an Sensoren vorbeifließen . Die hydrodynamische Fokussierung kann verwendet werden, um einzelne Zellen zu isolieren, so dass genauere Ergebnisse erzielt werden können: Die verdünnte Probe wird in einen Niederdruckfluidstrom injiziert, wodurch sich die Zellen in der Probe durch laminare Strömung in einer einzigen Reihe ausrichten .
Um die Hämoglobinkonzentration zu messen, wird der Probe eine Reagenzchemikalie zugesetzt, um die roten Blutkörperchen in einem Kanal zu zerstören (zu lysieren ), der von dem für die Anzahl der roten Blutkörperchen verwendeten Kanal getrennt ist. Bei Analysegeräten, die die Anzahl der weißen Blutkörperchen im selben Kanal wie die Hämoglobinmessung durchführen, können die weißen Blutkörperchen leichter gezählt werden. Hämatologieanalysatoren messen das Hämoglobin spektrophotometrisch und basieren auf der linearen Beziehung zwischen der Absorption von Licht und der Menge des vorhandenen Hämoglobins. Chemikalien werden verwendet, um verschiedene Formen von Hämoglobin wie Oxyhämoglobin und Carboxyhämoglobin in eine stabile Form, üblicherweise Cyanmethämoglobin , umzuwandeln und eine dauerhafte Farbänderung zu erzeugen. Die Absorption der resultierenden Farbe bei Messung bei einer bestimmten Wellenlänge - normalerweise 540 Nanometer - entspricht der Hämoglobinkonzentration.
Sensoren zählen und identifizieren die Zellen in der Probe nach zwei Hauptprinzipien: elektrische Impedanz und Lichtstreuung . Die impedanzbasierte Zellzählung arbeitet nach dem Coulter-Prinzip : Zellen sind in einer Flüssigkeit suspendiert, die elektrischen Strom führt , und verursachen beim Durchgang durch eine Öffnung aufgrund ihrer schlechten elektrischen Leitfähigkeit einen Stromabfall . Die Amplitude des Spannungsimpulses, der erzeugt wird, wenn eine Zelle die Öffnung kreuzt, korreliert mit der von der Zelle verdrängten Flüssigkeitsmenge und damit dem Volumen der Zelle, während die Gesamtzahl der Impulse mit der Anzahl der Zellen in der Probe korreliert. Die Verteilung der Zellvolumina wird in einem Histogramm aufgezeichnet , und durch Festlegen von Volumenschwellenwerten basierend auf den typischen Größen jedes Zelltyps können die verschiedenen Zellpopulationen identifiziert und gezählt werden.
Bei Lichtstreutechniken wird Licht von einem Laser oder einer Wolfram-Halogen-Lampe auf den Zellstrom gerichtet, um Informationen über ihre Größe und Struktur zu sammeln. Zellen streuen Licht in verschiedenen Winkeln, wenn sie den Strahl passieren, der mit Photometern erfasst wird . Die Vorwärtsstreuung, die sich auf die entlang der Strahlachse gestreute Lichtmenge bezieht, wird hauptsächlich durch Beugung des Lichts verursacht und korreliert mit der Zellgröße, während die Seitenstreuung (in einem 90-Grad-Winkel gestreutes Licht) durch Reflexion und Brechung verursacht wird und liefert Informationen über die zelluläre Komplexität.
Hochfrequenzbasierte Methoden können in Kombination mit Impedanz verwendet werden. Diese Techniken arbeiten nach dem gleichen Prinzip der Messung der Stromunterbrechung, wenn Zellen durch eine Apertur laufen. Da jedoch der hochfrequente HF-Strom in die Zellen eindringt, bezieht sich die Amplitude des resultierenden Impulses auf Faktoren wie die relative Größe des Kerns . die Struktur des Kerns und die Menge an Granulat im Zytoplasma . Kleine rote Blutkörperchen und Zelltrümmer, die ähnlich groß wie Blutplättchen sind, können die Blutplättchenzahl beeinträchtigen, und große Blutplättchen können möglicherweise nicht genau gezählt werden. Daher verwenden einige Analysegeräte zusätzliche Techniken zur Messung von Blutplättchen, wie z. B. Fluoreszenzfärbung und Mehrwinkellicht Streuung und Markierung monoklonaler Antikörper .
Die meisten Analysegeräte messen direkt die durchschnittliche Größe der roten Blutkörperchen, die als mittleres Zellvolumen (MCV) bezeichnet wird, und berechnen den Hämatokrit durch Multiplikation der Anzahl der roten Blutkörperchen mit dem MCV. Einige messen den Hämatokrit, indem sie das Gesamtvolumen der roten Blutkörperchen mit dem Volumen des entnommenen Blutes vergleichen und das MCV aus der Anzahl der Hämatokrit- und roten Blutkörperchen ableiten. Die Hämoglobinkonzentration, die Anzahl der roten Blutkörperchen und der Hämatokrit werden verwendet, um die durchschnittliche Menge an Hämoglobin innerhalb jeder roten Blutkörperchen, das mittlere korpuskuläre Hämoglobin (MCH), zu berechnen . und seine Konzentration die mittlere korpuskuläre Hämoglobinkonzentration (MCHC). Eine andere Berechnung, die Verteilungsbreite der roten Blutkörperchen (RDW), wird aus der Standardabweichung des mittleren Zellvolumens abgeleitet und spiegelt die Variation der Zellgröße wider.
Nach der Behandlung mit Reagenzien bilden weiße Blutkörperchen drei unterschiedliche Peaks, wenn ihre Volumina in einem Histogramm aufgezeichnet werden. Diese Peaks entsprechen Populationen von Granulozyten , mononukleären Zellen und Lymphozyten, so dass ein dreiteiliges Differential allein auf der Grundlage des Zellvolumens durchgeführt werden kann. Fortgeschrittenere Analysegeräte verwenden zusätzliche Techniken, um ein fünf- bis siebenteiliges Differential bereitzustellen, z. B. die Verwendung von Farbstoffen, um bestimmte Chemikalien in Zellen zu färben - beispielsweise Nukleinsäuren , die in höheren Konzentrationen in unreifen Zellen enthalten sind, oder Myeloperoxidase , ein Enzym, das in gefunden wird Zellen der myeloischen Linie . Basophile können in einem separaten Kanal gezählt werden, in dem ein Reagenz andere weiße Blutkörperchen zerstört und Basophile intakt lässt. Die aus diesen Messungen gesammelten Daten werden analysiert und in einem Streudiagramm aufgezeichnet , wo sie Cluster bilden, die mit jedem Typ weißer Blutkörperchen korrelieren. Ein weiterer Ansatz zur Automatisierung der Differentialzählung ist die Verwendung einer digitalen Mikroskopie-Software, die künstliche Intelligenz verwendet , um weiße Blutkörperchen anhand von Mikrofotografien des Blutausstrichs zu klassifizieren . Diese Technik erfordert jedoch eine Bestätigung durch manuelle Überprüfung.
Die meisten Analysegeräte benötigen weniger als eine Minute, um alle Tests im gesamten Blutbild durchzuführen. Da Analysegeräte viele einzelne Zellen abtasten und zählen, sind die Ergebnisse sehr präzise. Einige abnormale Zellen können jedoch möglicherweise nicht korrekt identifiziert werden. Dies erfordert eine manuelle Überprüfung der Ergebnisse des Instruments und die Identifizierung durch abnormale Zellen auf andere Weise, die das Instrument nicht kategorisieren konnte.
Point-of-Care-Tests
Point-of-Care-Tests beziehen sich auf Blutuntersuchungen, die außerhalb des Labors durchgeführt werden, z. B. am Krankenbett oder in einer Klinik. Diese Testmethode ist schneller und verbraucht weniger Blut als herkömmliche Methoden. Sie erfordert kein speziell geschultes Personal. Daher ist sie in Notsituationen und in Bereichen mit eingeschränktem Zugang zu Ressourcen nützlich. Zu den häufig verwendeten Geräten für hämatologische Tests am Behandlungsort gehören der HemoCue , ein tragbarer Analysator, der die Hämoglobinkonzentration der Probe mithilfe der Spektrophotometrie misst, und der i-STAT , aus dem ein Hämoglobinwert abgeleitet wird, indem die Konzentration der roten Blutkörperchen geschätzt wird die Leitfähigkeit des Blutes. Hämoglobin und Hämatokrit können an Point-of-Care-Geräten gemessen werden, die für Blutgastests ausgelegt sind. Diese Messungen korrelieren jedoch manchmal schlecht mit denen, die mit Standardmethoden erhalten wurden. Es gibt vereinfachte Versionen von Hämatologieanalysatoren, die für den Einsatz in Kliniken entwickelt wurden und ein vollständiges Blutbild und Differential liefern können.
Handbuch
Die Tests können manuell durchgeführt werden, wenn keine automatisierten Geräte verfügbar sind oder wenn die Ergebnisse des Analysators darauf hinweisen, dass weitere Untersuchungen erforderlich sind. Automatisierte Ergebnisse werden in 10–25% der Fälle für die manuelle Überprüfung des Blutausstrichs markiert. Dies kann auf abnormale Zellpopulationen zurückzuführen sein, die der Analysator nicht richtig zählen kann, auf interne Messwerte, die vom Analysator generiert wurden und darauf hindeuten, dass die Ergebnisse möglicherweise ungenau sind, oder auf numerische Ergebnisse, die nicht korrekt sind außerhalb der festgelegten Schwellenwerte fallen. Um diese Probleme zu untersuchen, wird aus der Blutprobe ein Abstrich gemacht, mit einem Romanowsky-Farbstoff angefärbt und unter einem Mikroskop untersucht . Das Auftreten der roten und weißen Blutkörperchen und Blutplättchen wird bewertet, und qualitative Anomalien werden gemeldet, falls vorhanden. Veränderungen im Erscheinungsbild roter Blutkörperchen können eine erhebliche diagnostische Bedeutung haben. Beispielsweise weist das Vorhandensein von Sichelzellen auf eine Sichelzellenerkrankung hin , und eine hohe Anzahl fragmentierter roter Blutkörperchen ( Schistozyten ) muss dringend untersucht werden, da dies auf ein Mikroangiopathikum hindeuten kann hämolytische Anämie . Bei einigen entzündlichen Erkrankungen und bei Paraproteinstörungen wie dem multiplen Myelom können hohe Proteinspiegel im Blut dazu führen, dass rote Blutkörperchen auf dem Abstrich, der als Rouleaux bezeichnet wird, gestapelt erscheinen . Einige parasitäre Erkrankungen wie Malaria und Babesiose können durch Auffinden der Erreger auf dem Blutausstrich erkannt werden, und die Thrombozytenzahl kann aus dem Blutausstrich geschätzt werden, was nützlich ist, wenn die automatisierten Thrombozytenergebnisse ungenau sind.
Um ein manuelles Differential der weißen Blutkörperchen durchzuführen, zählt der Mikroskopiker 100 Zellen auf dem Blutausstrich und klassifiziert sie anhand ihres Aussehens. manchmal werden 200 Zellen gezählt. Dies gibt den Prozentsatz jeder Art von weißen Blutkörperchen an, und durch Multiplizieren dieser Prozentsätze mit der Gesamtzahl der weißen Blutkörperchen kann die absolute Anzahl jeder Art von weißen Blutkörperchen erhalten werden. Manuelles Zählen unterliegen Fehler Abtasten weil so wenige Zellen gezählt werden verglichen mit automatisierter Analyse, aber es kann anormale Zellen identifizieren , dass Analysatoren können sie nicht, wie die Blastenzellen in akuter Leukämie gesehen. Klinisch signifikante Merkmale wie toxische Granulation und Vakuolisierung können auch durch mikroskopische Untersuchung weißer Blutkörperchen festgestellt werden.
Automatisierte Hämatokritmessungen können unter bestimmten Bedingungen falsch sein, z. B. bei Polyzythämie (stark erhöhte Anzahl roter Blutkörperchen) oder schwerer Leukozytose (stark erhöhte Anzahl weißer Blutkörperchen), die die Messung roter Blutkörperchen stört, indem weiße Blutkörperchen als gezählt werden rote Zellen). In diesen Fällen kann ein manueller Hämatokrit durchgeführt werden, indem ein Kapillarröhrchen mit Blut gefüllt, zentrifugiert und der Prozentsatz des Blutes gemessen wird, der aus roten Blutkörperchen besteht. Außerhalb dieser Bedingungen ist der automatisierte Hämatokrit genauer als der manuelle Hämatokrit.
Rote und weiße Blutkörperchen und Blutplättchen können unter dem Mikroskop mit einem Hämozytometer gezählt werden , einer mikroskopischen Kammer, die ein bestimmtes Volumen an verdünntem Blut enthält und mit einem kalibrierten Gitter geätzt wird, um die Zellzählung zu unterstützen. Die im Gitter des Hämozytometers sichtbaren Zellen werden gezählt und durch das untersuchte Blutvolumen geteilt, das aus der Anzahl der auf dem Gitter gezählten Quadrate bestimmt wird, um die Konzentration der Zellen in der Probe zu erhalten. Manuelle Zellzählungen sind arbeitsintensiv und im Vergleich zu automatisierten Methoden ungenau. Daher werden sie nur selten verwendet, außer in Labors, die keinen Zugang zu automatisierten Analysegeräten haben. Um weiße Blutkörperchen zu zählen, wird die Probe unter Verwendung einer Flüssigkeit verdünnt, die eine Verbindung enthält, die rote Blutkörperchen lysiert, wie Ammoniumoxalat , Essigsäure oder Salzsäure . Manchmal wird dem Verdünnungsmittel ein Fleck hinzugefügt, der die Kerne der weißen Blutkörperchen hervorhebt, wodurch sie leichter zu identifizieren sind. Manuelle Thrombozytenzahlen werden auf ähnliche Weise durchgeführt, obwohl bei einigen Methoden die roten Blutkörperchen intakt bleiben. Die Verwendung eines Phasenkontrastmikroskops anstelle eines Lichtmikroskops kann die Identifizierung von Blutplättchen erleichtern. Die manuelle Zählung der roten Blutkörperchen wird selten durchgeführt, da sie ungenau ist und andere Methoden wie die Hämoglobinometrie und der manuelle Hämatokrit zur Beurteilung der roten Blutkörperchen zur Verfügung stehen. Wenn dies jedoch erforderlich ist, können rote Blutkörperchen in mit Kochsalzlösung verdünntem Blut gezählt werden.
Hämoglobin kann manuell mit einem Spektrophotometer oder Kolorimeter gemessen werden . Um das Hämoglobin manuell zu messen, wird die Probe mit Reagenzien verdünnt, die rote Blutkörperchen zerstören, um das Hämoglobin freizusetzen. Andere Chemikalien werden verwendet, um verschiedene Arten von Hämoglobin in eine Form umzuwandeln, so dass es leicht gemessen werden kann. Die Lösung wird dann in eine Messküvette gegeben und die Extinktion bei einer bestimmten Wellenlänge gemessen, die von der Art des verwendeten Reagens abhängt. Ein Referenzstandard, der eine bekannte Menge an Hämoglobin enthält, wird verwendet, um die Beziehung zwischen der Absorption und der Hämoglobinkonzentration zu bestimmen, wodurch der Hämoglobinspiegel der Probe gemessen werden kann.
In ländlichen und wirtschaftlich benachteiligten Gebieten sind die verfügbaren Tests durch den Zugang zu Ausrüstung und Personal begrenzt. In Einrichtungen der Grundversorgung in diesen Regionen können die Tests auf die Untersuchung der Morphologie der roten Blutkörperchen und die manuelle Messung von Hämoglobin oder Hämatokrit beschränkt sein, während komplexere Techniken wie manuelle Zellzählungen und -differentiale und manchmal automatisierte Zellzählungen in Distriktlabors durchgeführt werden. Regionale und provinzielle Krankenhäuser und akademische Zentren haben normalerweise Zugang zu automatisierten Analysegeräten. Wenn keine Laboreinrichtungen verfügbar sind, kann eine Schätzung der Hämoglobinkonzentration erhalten werden, indem ein Blutstropfen auf eine standardisierte Art von absorbierendem Papier gegeben und mit einer Farbskala verglichen wird.
Qualitätskontrolle
Automatisierte Analysegeräte müssen regelmäßig kalibriert werden . Die meisten Hersteller liefern konserviertes Blut mit definierten Parametern und die Analysegeräte werden angepasst, wenn die Ergebnisse außerhalb der definierten Schwellenwerte liegen. Um sicherzustellen, dass die Ergebnisse weiterhin genau sind, werden Qualitätskontrollproben, die normalerweise vom Gerätehersteller bereitgestellt werden, mindestens einmal pro Tag getestet. Die Proben sind so formuliert, dass sie spezifische Ergebnisse liefern, und die Laboratorien vergleichen ihre Ergebnisse mit den bekannten Werten, um sicherzustellen, dass das Instrument ordnungsgemäß funktioniert. Für Laboratorien ohne Zugang zu kommerziellem Qualitätskontrollmaterial empfiehlt eine indische Regulierungsorganisation, Patientenproben doppelt durchzuführen und die Ergebnisse zu vergleichen. Eine gleitende Durchschnittsmessung , bei der die Durchschnittsergebnisse für Patientenproben in Intervallen gemessen werden, kann als zusätzliche Qualitätskontrolle verwendet werden. Unter der Annahme, dass die Merkmale der Patientenpopulation über die Zeit ungefähr gleich bleiben, sollte der Durchschnitt konstant bleiben; Große Verschiebungen des Durchschnittswerts können auf Geräteprobleme hinweisen. Die MCHC-Werte sind in dieser Hinsicht besonders nützlich.
Zusätzlich zur Analyse interner Qualitätskontrollproben mit bekannten Ergebnissen können Laboratorien externe Qualitätsbewertungsproben von Regulierungsorganisationen erhalten. Während der Zweck der internen Qualitätskontrolle darin besteht, sicherzustellen, dass die Ergebnisse des Analysators innerhalb eines bestimmten Labors reproduzierbar sind , bestätigt die externe Qualitätsbewertung, dass die Ergebnisse verschiedener Laboratorien miteinander und mit den Zielwerten übereinstimmen. Die erwarteten Ergebnisse für externe Qualitätsbewertungsproben werden dem Labor nicht mitgeteilt. Externe Qualitätsbewertungsprogramme wurden in Nordamerika und Westeuropa weitgehend übernommen, und Laboratorien müssen häufig an diesen Programmen teilnehmen, um die Akkreditierung aufrechtzuerhalten . Logistische Probleme können es Laboratorien in Gebieten mit unzureichenden Ressourcen erschweren, externe Qualitätsbewertungssysteme umzusetzen.
Eingeschlossene Tests
Die Tests in der CBC messen die Mengen an Blutplättchen und roten und weißen Blutkörperchen sowie die Hämoglobin- und Hämatokritwerte. Die Indizes der roten Blutkörperchen - MCV, MCH und MCHC -, die die Größe der roten Blutkörperchen und ihren Hämoglobingehalt beschreiben, werden zusammen mit der Verteilungsbreite der roten Blutkörperchen (RDW) angegeben, die das Ausmaß der Variation der Größen der roten Blutkörperchen misst Zellen. Ein Differential der weißen Blutkörperchen, das die verschiedenen Arten der weißen Blutkörperchen auflistet, kann durchgeführt werden, und manchmal ist eine Retikulozytenzahl enthalten.
Rote Blutkörperchen, Hämoglobin und Hämatokrit
| Analyt | Ergebnis | Normalbereich |
|---|---|---|
| Erythrozytenzahl | 5,5 x 10 12 / l | 4.5–5.7 |
| Anzahl der weißen Blutkörperchen | 9,8 x 10 9 / L. | 4.0–10.0 |
| Hämoglobin | 123 g / l | 133–167 |
| Hämatokrit | 0,42 | 0,35–0,53 |
| MCV | 76 fL | 77–98 |
| MCH | 22,4 pg | 26–33 |
| MCHC | 293 g / l | 330–370 |
| RDW | 14,5% | 10.3–15.3 |
Rote Blutkörperchen liefern Sauerstoff aus der Lunge an das Gewebe und transportieren bei ihrer Rückkehr Kohlendioxid zurück in die Lunge, wo es ausgeatmet wird. Diese Funktionen werden durch das Hämoglobin der Zellen vermittelt. Der Analysator zählt die roten Blutkörperchen und gibt das Ergebnis in Einheiten von 10 6 Zellen pro Mikroliter Blut (× 10 6 / μl) oder 10 12 Zellen pro Liter (× 10 12 / L) an und misst deren durchschnittliche Größe, die als bezeichnet wird das mittlere Zellvolumen und ausgedrückt in Femtolitern oder kubischen Mikrometern. Durch Multiplikation des mittleren Zellvolumens mit der Anzahl der roten Blutkörperchen kann der Hämatokrit (HCT) oder das Volumen der gepackten Zellen (PCV), eine Messung des Prozentsatzes an Blut, der aus roten Blutkörperchen besteht, abgeleitet werden. Wenn umgekehrt der Hämatokrit mit manuellen Methoden oder mit Analysegeräten durchgeführt wird, die den Hämatokrit direkt messen, wird das mittlere Zellvolumen aus dem Hämatokrit und der Anzahl der roten Blutkörperchen berechnet. Hämoglobin, gemessen nach der Lysierung der roten Blutkörperchen, wird in Einheiten von Gramm pro Liter (g / l) oder Gramm pro Deziliter (g / dl) angegeben. Unter der Annahme, dass die roten Blutkörperchen normal sind, besteht eine konstante Beziehung zwischen Hämoglobin und Hämatokrit: Der Hämatokrit-Prozentsatz ist ungefähr dreimal höher als der Hämoglobinwert in g / dl plus oder minus drei. Diese Beziehung, die als Dreierregel bezeichnet wird , kann verwendet werden, um zu bestätigen, dass die CBC-Ergebnisse korrekt sind.
Zwei weitere Messungen werden aus der Anzahl der roten Blutkörperchen, der Hämoglobinkonzentration und dem Hämatokrit berechnet: dem mittleren korpuskulären Hämoglobin und der mittleren korpuskulären Hämoglobinkonzentration . Diese Parameter beschreiben den Hämoglobingehalt jeder roten Blutkörperchen. MCH und MCHC können verwirrend sein; Im Wesentlichen ist der MCH ein Maß für die durchschnittliche Menge an Hämoglobin pro roten Blutkörperchen. Das MCHC gibt den durchschnittlichen Anteil der Zelle an, der Hämoglobin ist. Das MCH berücksichtigt nicht die Größe der roten Blutkörperchen, während das MCHC dies tut. Zusammen werden MCV, MCH und MCHC als Indizes für rote Blutkörperchen bezeichnet . Änderungen dieser Indizes sind auf dem Blutausstrich sichtbar: Rote Blutkörperchen, die ungewöhnlich groß oder klein sind, können durch Vergleich mit der Größe der weißen Blutkörperchen identifiziert werden, und Zellen mit einer niedrigen Hämoglobinkonzentration erscheinen blass. Ein weiterer Parameter wird aus den anfänglichen Messungen der roten Blutkörperchen berechnet: die Verteilungsbreite der roten Blutkörperchen oder RDW, die den Grad der Variation der Zellengröße widerspiegelt.

Eine ungewöhnlich niedrige Hämoglobin-, Hämatokrit- oder Erythrozytenzahl weist auf eine Anämie hin. Anämie ist keine Diagnose für sich, sondern weist auf eine Grunderkrankung hin, die die roten Blutkörperchen der Person betrifft. Allgemeine Ursachen für Anämie sind Blutverlust, Produktion defekter roter Blutkörperchen (ineffektive Erythropoeisis ), verminderte Produktion roter Blutkörperchen (unzureichende Erythropoeisis) und erhöhte Zerstörung roter Blutkörperchen ( hämolytische Anämie ). Anämie verringert die Fähigkeit des Blutes, Sauerstoff zu transportieren, was zu Symptomen wie Müdigkeit und Atemnot führt. Wenn der Hämoglobinspiegel aufgrund des klinischen Zustands der Person unter die Schwellenwerte fällt, kann eine Bluttransfusion erforderlich sein.
Eine erhöhte Anzahl roter Blutkörperchen, die normalerweise zu einem Anstieg des Hämoglobins und des Hämatokrits führt, wird als Polyzythämie bezeichnet. Dehydration oder die Verwendung von Diuretika kann zu Polyzythämie führen, indem die Menge an Blutplasma im Vergleich zu roten Blutkörperchen verringert wird. Polyzythämie kann auch auftreten, wenn der Körper mehr rote Blutkörperchen produziert, um chronisch niedrige Sauerstoffwerte bei Erkrankungen wie Lungen- oder Herzerkrankungen auszugleichen , oder wenn eine Person ungewöhnlich hohe Erythropoietinspiegel (EPO) hat, ein Hormon, das die Produktion roter Blutkörperchen stimuliert . Bei der Polyzythämie vera produziert das Knochenmark übermäßig hohe Erythrozyten und andere Blutzellen.
Die Bewertung der Indizes der roten Blutkörperchen ist hilfreich bei der Bestimmung der Ursache der Anämie. Wenn das MCV niedrig ist, wird die Anämie als mikrozytisch bezeichnet , während eine Anämie mit einem hohen MCV als makrozytische Anämie bezeichnet wird . Eine Anämie mit niedrigem MCHC wird als hypochrome Anämie bezeichnet . Wenn eine Anämie vorliegt, die Indizes der roten Blutkörperchen jedoch normal sind, wird die Anämie als normochrom und normozytisch angesehen . Der Begriff Hyperchromie , der sich auf einen hohen MCHC bezieht, wird im Allgemeinen nicht verwendet, da eine Erhöhung des MCHC über den oberen Referenzwert selten ist und hauptsächlich unter Bedingungen auftritt, die zu einer abnormalen Form der roten Blutkörperchen führen, wie Sphärozytose , Sichelzellenkrankheit und Hämoglobin C-Krankheit . Ein erhöhter MCHC kann auch ein falsches Ergebnis von Zuständen wie Agglutination roter Blutkörperchen (die eine falsche Abnahme der Anzahl roter Blutkörperchen, Erhöhung des MCHC verursacht) oder stark erhöhten Mengen an Lipiden im Blut (was einen falschen Anstieg des Blutzuckers verursacht) sein Hämoglobin-Ergebnis).
Eine mikrozytische Anämie ist typischerweise mit Eisenmangel, Thalassämie und Anämie bei chronischen Erkrankungen verbunden , während eine makrozytische Anämie mit Alkoholismus , Folsäure- und B12-Mangel , dem Gebrauch einiger Medikamente und einigen Knochenmarkerkrankungen verbunden ist. Akuter Blutverlust, hämolytische Anämie, Knochenmarkstörungen und verschiedene chronische Erkrankungen können zu Anämie mit einem normozytären Blutbild führen. Das MCV dient einem zusätzlichen Zweck bei der Qualitätskontrolle im Labor. Es ist im Vergleich zu anderen CBC-Parametern über die Zeit relativ stabil, sodass eine große Änderung des MCV darauf hinweisen kann, dass die Probe vom falschen Patienten entnommen wurde. Ein niedriger RDW hat keine klinische Bedeutung, aber ein erhöhter RDW bedeutet eine erhöhte Variation der Größe der roten Blutkörperchen, ein Zustand, der als Anisozytose bekannt ist . Anisozytose tritt häufig bei Ernährungsanämien wie Eisenmangelanämie und Anämie aufgrund von Vitamin B12 oder Folatmangel auf, während Menschen mit Thalassämie möglicherweise ein normales RDW haben. Basierend auf den CBC-Ergebnissen können weitere Schritte zur Untersuchung der Anämie unternommen werden, beispielsweise ein Ferritin- Test zur Bestätigung des Vorhandenseins eines Eisenmangels oder eine Hämoglobin-Elektrophorese zur Diagnose einer Hämoglobinopathie wie Thalassämie oder Sichelzellenerkrankung.
weiße Blutkörperchen
|
|
Weiße Blutkörperchen verteidigen sich gegen Infektionen und sind an der Entzündungsreaktion beteiligt . Eine hohe Anzahl weißer Blutkörperchen, die als Leukozytose bezeichnet wird, tritt häufig bei Infektionen, Entzündungen und physiologischen Stresszuständen auf . Es kann auch durch Krankheiten verursacht werden, die eine abnormale Produktion von Blutzellen beinhalten, wie myeloproliferative und lymphoproliferative Störungen. Eine verringerte Leukozytenzahl , Leukopenie genannt , kann zu einem erhöhten Infektionsrisiko führen und tritt bei Behandlungen wie Chemotherapie und Strahlentherapie sowie bei vielen Erkrankungen auf, die die Produktion von Blutzellen hemmen. Sepsis ist sowohl mit Leukozytose als auch mit Leukopenie verbunden. Die Gesamtzahl der weißen Blutkörperchen wird normalerweise in Zellen pro Mikroliter Blut (/ μl) oder 10 9 Zellen pro Liter (× 10 9 / L) angegeben.
Im Differential der weißen Blutkörperchen werden die verschiedenen Arten von weißen Blutkörperchen identifiziert und gezählt. Die Ergebnisse werden als Prozentsatz und als absolute Zahl pro Volumeneinheit angegeben. Typischerweise werden fünf Arten weißer Blutkörperchen gemessen - Neutrophile , Lymphozyten , Monozyten , Eosinophile und Basophile . Einige Instrumente geben die Anzahl der unreifen Granulozyten an. Dies ist eine Klassifizierung, die aus Vorläufern von Neutrophilen besteht. speziell Promyelozyten , Myelozyten und Metamyelozyten . Andere Zelltypen werden gemeldet, wenn sie im manuellen Differential angegeben sind.
Differenzielle Ergebnisse sind nützlich bei der Diagnose und Überwachung vieler Erkrankungen. Beispielsweise ist eine erhöhte Neutrophilenzahl ( Neutrophilie ) mit bakteriellen Infektionen, Entzündungen und myeloproliferativen Störungen verbunden, während eine verringerte Anzahl ( Neutropenie ) bei Personen auftreten kann, die sich einer Chemotherapie unterziehen oder bestimmte Medikamente einnehmen oder an Krankheiten leiden, die das Knochenmark betreffen . Neutropenie kann auch durch einige angeborene Störungen verursacht werden und kann vorübergehend nach viralen oder bakteriellen Infektionen bei Kindern auftreten. Menschen mit schwerer Neutropenie und klinischen Anzeichen einer Infektion werden mit Antibiotika behandelt, um potenziell lebensbedrohlichen Krankheiten vorzubeugen.

Eine erhöhte Anzahl von Band Neutrophilen Neutrophile -Young , die segmentkernigen-oder unreife Granulozyten fehlen wird als Linksverschiebung und tritt bei Sepsis und einigen Blutkrankheiten, ist aber in der Schwangerschaft normal. Eine erhöhte Lymphozytenzahl ( Lymphozytose ) ist mit einer Virusinfektion und lymphoproliferativen Störungen wie chronischer lymphatischer Leukämie verbunden . erhöhte Monozytenzahlen ( Monozytose ) sind mit chronischen Entzündungszuständen verbunden; und die Eosinophilenzahl ist bei parasitären Infektionen und allergischen Zuständen häufig erhöht ( Eosinophilie ). Eine erhöhte Anzahl von Basophilen, die als Basophilie bezeichnet werden , kann bei myeloproliferativen Erkrankungen wie chronischer myeloischer Leukämie und Polyzythämie vera auftreten. Das Vorhandensein einiger Arten abnormaler Zellen, wie Blastenzellen oder Lymphozyten mit neoplastischen Merkmalen, deutet auf eine hämatologische Malignität hin .
Thrombozyten
Thrombozyten spielen eine wesentliche Rolle bei der Gerinnung. Wenn die Wand eines Blutgefäßes beschädigt ist, haften Blutplättchen an der freiliegenden Oberfläche an der Stelle der Verletzung und verschließen den Spalt. Die gleichzeitige Aktivierung der Gerinnungskaskade führt zur Bildung von Fibrin , das den Blutplättchenpfropfen verstärkt, um ein stabiles Gerinnsel zu erzeugen . Eine niedrige Thrombozytenzahl, bekannt als Thrombozytopenie, kann bei schweren Blutungen zu Blutungen führen. Es kann bei Personen auftreten, die sich Behandlungen unterziehen, die das Knochenmark unterdrücken, wie z. B. Chemotherapie oder Strahlentherapie, oder bestimmte Medikamente wie Heparin einnehmen, die das Immunsystem dazu bringen können, Blutplättchen zu zerstören. Thrombozytopenie ist ein Merkmal vieler Bluterkrankungen wie akuter Leukämie und aplastischer Anämie sowie einiger Autoimmunerkrankungen . Wenn die Thrombozytenzahl extrem niedrig ist, kann eine Thrombozyten-Transfusion durchgeführt werden. Thrombozytose , dh eine hohe Thrombozytenzahl, kann bei Entzündungs- oder Traumazuständen sowie bei Eisenmangel auftreten, und die Thrombozytenzahl kann bei Menschen mit essentieller Thrombozythämie , einer seltenen Blutkrankheit , außergewöhnlich hohe Werte erreichen . Die Thrombozytenzahl kann in Einheiten von Zellen pro Mikroliter Blut (/ μl), 10 3 Zellen pro Mikroliter (× 10 3 / μl) oder 10 9 Zellen pro Liter (× 10 9 / L) angegeben werden.
Das mittlere Thrombozytenvolumen (MPV) misst die durchschnittliche Größe der Thrombozyten in Femtolitern. Es kann bei der Bestimmung der Ursache der Thrombozytopenie hilfreich sein. Ein erhöhter MPV kann auftreten, wenn junge Blutplättchen in den Blutkreislauf freigesetzt werden, um eine erhöhte Zerstörung der Blutplättchen auszugleichen, während eine verringerte Produktion von Blutplättchen aufgrund einer Funktionsstörung des Knochenmarks zu einem niedrigen MPV führen kann. Das MPV ist auch nützlich zur Unterscheidung zwischen angeborenen Krankheiten, die Thrombozytopenie verursachen. Die unreife Blutplättchenfraktion (IPF) oder die Anzahl der retikulierten Blutplättchen wird von einigen Analysegeräten angegeben und liefert Informationen über die Geschwindigkeit der Blutplättchenproduktion durch Messung der Anzahl unreifer Blutplättchen im Blut.
Andere Tests
Retikulozytenzahl

Retikulozyten sind unreife rote Blutkörperchen, die im Gegensatz zu den reifen Zellen RNA enthalten . Eine Retikulozytenzahl wird manchmal als Teil eines vollständigen Blutbildes durchgeführt, normalerweise um die Ursache der Anämie einer Person zu untersuchen oder ihr Ansprechen auf die Behandlung zu bewerten. Eine Anämie mit einer hohen Retikulozytenzahl kann darauf hinweisen, dass das Knochenmark mit einer höheren Rate rote Blutkörperchen produziert, um Blutverlust oder Hämolyse auszugleichen, während eine Anämie mit einer niedrigen Retikulozytenzahl darauf hindeuten kann, dass die Person einen Zustand hat, der die Fähigkeit des Körpers verringert produzieren rote Blutkörperchen. Wenn Menschen mit Ernährungsanämie eine Nahrungsergänzung erhalten, zeigt eine Erhöhung der Retikulozytenzahl an, dass ihr Körper auf die Behandlung reagiert, indem er mehr rote Blutkörperchen produziert. Hämatologische Analysegeräte führen Retikulozytenzählungen durch, indem sie rote Blutkörperchen mit einem Farbstoff färben, der an RNA bindet, und die Anzahl der Retikulozyten durch Lichtstreuung oder Fluoreszenzanalyse messen. Der Test kann manuell durchgeführt werden, indem das Blut mit neuem Methylenblau gefärbt wird , das an RNA bindet, und der Prozentsatz der RNA enthaltenden roten Blutkörperchen unter dem Mikroskop gezählt wird. Die Retikulozytenzahl wird als absolute Zahl oder als Prozentsatz der roten Blutkörperchen ausgedrückt.
Einige Instrumente messen die durchschnittliche Menge an Hämoglobin in jedem Retikulozyten; Ein Parameter, der als Indikator für Eisenmangel bei Menschen mit Bedingungen untersucht wurde, die Standardtests beeinträchtigen. Die unreife Retikulozytenfraktion (IRF) ist eine weitere Messung, die von einigen Analysegeräten durchgeführt wird und die Reife von Retikulozyten quantifiziert: Weniger reife Zellen enthalten mehr RNA und erzeugen somit ein stärkeres Fluoreszenzsignal. Diese Informationen können bei der Diagnose von Anämien und der Bewertung der Produktion roter Blutkörperchen nach einer Anämiebehandlung oder Knochenmarktransplantation hilfreich sein .
Kernhaltige rote Blutkörperchen
Während ihrer Bildung im Knochenmark und in Leber und Milz bei Feten enthalten rote Blutkörperchen einen Zellkern, der normalerweise in den reifen Zellen, die im Blutkreislauf zirkulieren, fehlt. Wenn das Vorhandensein von kernhaltigen roten Blutkörperchen, insbesondere bei Kindern und Erwachsenen, festgestellt wird, weist dies auf einen erhöhten Bedarf an roten Blutkörperchen hin, der durch Blutungen, einige Krebsarten und Anämie verursacht werden kann. Die meisten Analysatoren können diese Zellen als Teil der differentiellen Zellzahl erkennen. Eine hohe Anzahl kernhaltiger roter Blutkörperchen kann zu einer falsch hohen Anzahl weißer Blutkörperchen führen, die angepasst werden müssen.
Andere Parameter
Fortschrittliche Hämatologieanalysatoren generieren neuartige Messungen von Blutzellen, die in Forschungsstudien diagnostische Bedeutung gezeigt haben, aber noch keine weit verbreitete klinische Verwendung gefunden haben. Beispielsweise erzeugen einige Arten von Analysatoren Koordinatenablesungen , die die Größe und Position jedes Clusters weißer Blutkörperchen angeben. Diese Parameter (als Zellpopulationsdaten bezeichnet) wurden als potenzielle Marker für Bluterkrankungen, bakterielle Infektionen und Malaria untersucht. Analysatoren, die Myeloperoxidase-Färbung verwenden, um unterschiedliche Zählungen zu erzeugen, können die Expression des Enzyms durch weiße Blutkörperchen quantifizieren, das bei verschiedenen Erkrankungen verändert wird. Einige Instrumente können zusätzlich zum durchschnittlichen MCHC-Wert den Prozentsatz der hypochromen roten Blutkörperchen angeben oder eine Anzahl fragmentierter roter Blutkörperchen ( Schistozyten ) angeben , die bei einigen Arten von hämolytischer Anämie auftreten. Da diese Parameter häufig für bestimmte Marken von Analysegeräten spezifisch sind, ist es für Laboratorien schwierig, die Ergebnisse zu interpretieren und zu vergleichen.
Referenzbereiche
| Prüfung | Einheiten | Erwachsene | Pädiatrisch
(4–7 Jahre alt) |
Neugeborene
(0–1 Tage alt) |
|---|---|---|---|---|
| WBC | × 10 9 / L. | 3.6–10.6 | 5.0–17.0 | 9.0–37.0 |
| RBC | × 10 12 / L. | 4.00–5.20 | 4.10–6.10 | |
| HGB | g / l | 102–152 | 165–215 | |
| HCT | L / L. | 0,36–0,46 | 0,48–0,68 | |
| MCV | fL | 80–100 | 78–94 | 95–125 |
| MCH | pg | 26–34 | 23–31 | 30–42 |
| MCHC | g / l | 320–360 | 320–360 | 300–340 |
| RDW | %. | 11.5–14.5 | 11.5–14.5 | erhöht |
| PLT | × 10 9 / L. | 150–450 | 150–450 | 150–450 |
| Neutrophile | × 10 9 / L. | 1.7–7.5 | 1,5–11,0 | 3.7–30.0 |
| Lymphozyten | × 10 9 / L. | 1.0–3.2 | 1.5–11.1 | 1.6–14.1 |
| Monozyten | × 10 9 / L. | 0,1–1,3 | 0,1–1,9 | 0,1–4,4 |
| Eosinophile | × 10 9 / L. | 0,0–0,3 | 0,0–0,7 | 0,0–1,5 |
| Basophile | × 10 9 / L. | 0,0–0,2 | 0,0–0,3 | 0,0–0,7 |
Vollständige Blutbildtests werden interpretiert, indem die Ausgabe mit Referenzbereichen verglichen wird, die die Ergebnisse darstellen, die bei 95% der scheinbar gesunden Menschen gefunden wurden. Basierend auf einer statistischen Normalverteilung variieren die Bereiche der getesteten Proben je nach Geschlecht und Alter. Im Durchschnitt haben erwachsene Frauen niedrigere Werte für Hämoglobin, Hämatokrit und rote Blutkörperchen als Männer. Der Unterschied nimmt zwar ab, ist aber nach den Wechseljahren immer noch vorhanden .
Das Blut von Neugeborenen unterscheidet sich stark von dem von älteren Kindern, was sich wiederum vom Blut von Erwachsenen unterscheidet. Das Hämoglobin, der Hämatokrit und die Anzahl der roten Blutkörperchen bei Neugeborenen sind extrem hoch, um niedrige Sauerstoffwerte im Mutterleib und einen hohen Anteil an fötalem Hämoglobin auszugleichen , das weniger wirksam Sauerstoff an Gewebe abgibt als reife Formen von Hämoglobin in ihren roten Blutkörperchen Blutzellen. Das MCV ist ebenfalls erhöht, und die Anzahl der weißen Blutkörperchen ist mit einem überwiegenden Anteil an Neutrophilen erhöht. Die Anzahl der roten Blutkörperchen und die damit verbundenen Werte beginnen kurz nach der Geburt abzunehmen, erreichen ihren tiefsten Punkt im Alter von etwa zwei Monaten und steigen danach an. Die roten Blutkörperchen älterer Säuglinge und Kinder sind mit einem niedrigeren MCH kleiner als die von Erwachsenen. Im pädiatrischen Differential der weißen Blutkörperchen überwiegen die Lymphozyten häufig die Neutrophilen, während bei Erwachsenen die Neutrophilen überwiegen.
Andere Unterschiede zwischen den Populationen können sich auf die Referenzbereiche auswirken: Beispielsweise weisen Menschen in höheren Lagen höhere Hämoglobin-, Hämatokrit- und RBC-Ergebnisse auf, und Menschen mit afrikanischem Erbe weisen im Durchschnitt niedrigere Werte für weiße Blutkörperchen auf. Der Typ des Analysators, mit dem die CBC ausgeführt wird, wirkt sich auch auf die Referenzbereiche aus. Referenzbereiche werden daher von einzelnen Labors basierend auf ihren eigenen Patientenpopulationen und Geräten festgelegt.
Einschränkungen
Einige Erkrankungen oder Probleme mit der Blutprobe können zu ungenauen vollständigen Blutbildergebnissen führen. Wenn die Probe sichtbar geronnen ist, was durch eine schlechte Phlebotomietechnik verursacht werden kann, ist sie für Tests nicht geeignet, da die Thrombozytenzahl fälschlicherweise verringert wird und andere Ergebnisse abnormal sein können. Bei Raumtemperatur gelagerte Proben können zu falsch hohen MCV-Werten führen, da rote Blutkörperchen anschwellen, wenn sie Wasser aus dem Plasma absorbieren. Die unterschiedlichen Ergebnisse von Blutplättchen und weißen Blutkörperchen können bei gealterten Proben ungenau sein, da sich die Zellen im Laufe der Zeit verschlechtern.

Proben von Personen mit sehr hohen gezogen Bilirubin oder Lipide in ihrem Plasma (bezeichnet als icteric Probe oder eine lipämisches Probe, respectively) zeigen kann falsch hohe Messwerte für Hämoglobin, da diese Substanzen die Farbe und die Trübung der Probe zu ändern, die stört die Hämoglobinmessung. Dies kann vermieden werden, indem das lipämische oder ikterische Plasma durch Kochsalzlösung ersetzt wird.
Einige Individuen produzieren einen Antikörper , der ihre Blutplättchen verklumpt, wenn ihr Blut in Röhrchen gezogen wird, die EDTA enthalten, das Antikoagulans, das typischerweise zum Sammeln vollständiger Blutbildproben verwendet wird. Thrombozytenklumpen können von automatisierten Analysegeräten als einzelne Thrombozyten gezählt werden, was zu einer fälschlicherweise verringerten Thrombozytenzahl führt. Dies kann durch Verwendung eines alternativen Antikoagulans wie Natriumcitrat oder Heparin vermieden werden . Eine Blutplättchenverklumpung kann auftreten, wenn die Probe aufgrund einer schwierigen Blutentnahme zu gerinnen beginnt.
Eine weitere durch Antikörper vermittelte Erkrankung, die das vollständige Blutbild beeinflussen kann, ist die Agglutination roter Blutkörperchen . Dieses Phänomen führt dazu, dass rote Blutkörperchen aufgrund von an die Zelloberfläche gebundenen Antikörpern zusammenklumpen. Aggregate roter Blutkörperchen werden vom Analysegerät als einzelne Zellen gezählt, was zu einer deutlich verringerten Anzahl roter Blutkörperchen und einem deutlich verringerten Hämatokrit sowie zu einem deutlich erhöhten MCV und MCHC führt. Oft sind diese Antikörper nur bei Raumtemperatur aktiv (in diesem Fall werden sie als kalte Agglutinine bezeichnet ), und die Agglutination kann durch Erhitzen der Probe auf 37 ° C (99 ° F) umgekehrt werden. Proben von Menschen mit warmer hämolytischer Autoimmunanämie können eine Agglutination der roten Blutkörperchen aufweisen, die sich beim Erwärmen nicht auflöst.
Während Blasten- und Lymphomzellen im manuellen Differential identifiziert werden können, kann die mikroskopische Untersuchung die Abstammungslinie der Zellen nicht zuverlässig bestimmen, was häufig für die Diagnose von Blutkrebs erforderlich ist. Nachdem abnormale Zellen identifiziert wurden, können zusätzliche Techniken wie die Immunphänotypisierung durch Durchflusszytometrie verwendet werden, um Marker zu identifizieren , die zusätzliche Informationen über die Zellen liefern.
Geschichte
Vor der Einführung automatisierter Zellzähler wurden vollständige Blutbildtests manuell durchgeführt: weiße und rote Blutkörperchen und Blutplättchen wurden unter Verwendung von Mikroskopen gezählt. Die früheste Person, die mikroskopische Beobachtungen von Blutzellen veröffentlichte, war Antonie van Leeuwenhoek , die 1675 sein Blut durch ein Mikroskop seines eigenen Designs betrachtete und es als "kleine rote Kügelchen, die durch eine kristalline Wasserfeuchtigkeit getrieben werden" bezeichnete. Während des 18. und 19. Jahrhunderts ermöglichten Verbesserungen der Mikroskoptechnologie wie achromatische Linsen die Zählung weißer Blutkörperchen und Blutplättchen in nicht gefärbten Proben.
Dem Physiologen Karl von Vierordt wird die Durchführung des ersten Blutbildes im Jahr 1852 zugeschrieben. Bei seiner Technik wurde ein sorgfältig gemessenes Blutvolumen in ein Kapillarröhrchen abgesaugt und auf einem mit Eiweiß beschichteten Objektträger verteilt . Nachdem das Blut getrocknet war, zählte er jede Zelle auf dem Objektträger; Dieser Vorgang kann mehr als drei Stunden dauern. Das 1874 von Louis-Charles Malassez eingeführte Hämozytometer vereinfachte die mikroskopische Zählung von Blutzellen. Das Hämozytometer von Malassez bestand aus einem Objektträger mit einem abgeflachten Kapillarröhrchen. Verdünntes Blut wurde mittels eines an einem Ende angebrachten Gummischlauchs in die Kapillarkammer eingeführt, und ein Okular mit einem skalierten Gitter wurde am Mikroskop angebracht, so dass der Mikroskopiker die Anzahl der Zellen pro Blutvolumen zählen konnte. Im Jahr 1877 erfand William Gowers ein Hämozytometer mit integriertem Zählgitter, sodass für jedes Mikroskop keine speziell kalibrierten Okulare hergestellt werden müssen.

In den 1870er Jahren entwickelte Paul Ehrlich eine Färbetechnik unter Verwendung einer Kombination aus saurem und basischem Farbstoff, mit der verschiedene Arten weißer Blutkörperchen unterschieden und die Morphologie roter Blutkörperchen untersucht werden konnten. Dmitri Leonidovich Romanowsky verbesserte diese Technik in den 1890er Jahren, indem er eine Mischung aus Eosin und gealtertem Methylenblau verwendete, um eine breite Palette von Farbtönen zu erzeugen, die nicht vorhanden waren, wenn einer der Flecken allein verwendet wurde. Dies wurde zur Grundlage für die Romanowsky-Färbung, eine Technik, die immer noch zum Färben von Blutausstrichen zur manuellen Überprüfung verwendet wird.
Die ersten Techniken zur Messung von Hämoglobin wurden Ende des 19. Jahrhunderts entwickelt und umfassten visuelle Vergleiche der Farbe von verdünntem Blut mit einem bekannten Standard. Versuche, diesen Prozess mittels Spektrophotometrie und Kolorimetrie zu automatisieren, wurden durch die Tatsache eingeschränkt, dass Hämoglobin in vielen verschiedenen Formen im Blut vorhanden ist, was bedeutet, dass es nicht bei einer einzelnen Wellenlänge gemessen werden konnte . 1920 wurde eine Methode eingeführt, um die verschiedenen Formen von Hämoglobin in eine stabile Form (Cyanmethämoglobin oder Hemiglobincyanid) umzuwandeln, mit der die Hämoglobinspiegel automatisch gemessen werden können. Die Cyanmethämoglobin-Methode bleibt die Referenzmethode für die Hämoglobin-Messung und wird immer noch in vielen automatisierten Hämatologieanalysatoren verwendet.
Maxwell Wintrobe wird die Erfindung des Hämatokrit-Tests zugeschrieben. 1929 führte er ein Doktorandenprojekt an der Universität von Tulane durch , um Normalbereiche für Parameter roter Blutkörperchen zu bestimmen, und erfand eine Methode, die als Wintrobe-Hämatokrit bekannt ist. Hämatokritmessungen waren zuvor in der Literatur beschrieben worden, aber die Methode von Wintrobe unterschied sich darin, dass ein großes Rohr verwendet wurde, das nach präzisen Spezifikationen in Massenproduktion hergestellt werden konnte. Bei der Wintrobe-Methode wurde das Blut eine Stunde lang aufrecht in einem Glasröhrchen stehen gelassen, dann zentrifugiert und der Prozentsatz der roten Blutkörperchen gegenüber dem Prozentsatz des Plasmas gemessen, um den Hämatokrit zu bestimmen. Die Erfindung eines reproduzierbaren Verfahrens zur Bestimmung von Hämatokritwerten ermöglichte es Wintrobe, die Indizes der roten Blutkörperchen zu definieren.
Die Forschung zur automatisierten Zellzählung begann im frühen 20. Jahrhundert. Eine 1928 entwickelte Methode verwendete die durch eine photometrische Messung durch eine verdünnte Blutprobe übertragene Lichtmenge, um die Anzahl der roten Blutkörperchen abzuschätzen. Dies erwies sich jedoch für Proben mit abnormalen roten Blutkörperchen als ungenau. Andere Versuche in den 1930er und 1940er Jahren betrafen fotoelektrische Detektoren, die an Mikroskopen angebracht waren und die Zellen beim Scannen zählten. Diese Methoden waren nicht erfolgreich. In den späten 1940er Jahren versuchte Wallace H. Coulter , motiviert durch die Notwendigkeit besserer Methoden zur Zählung roter Blutkörperchen nach der Bombardierung von Hiroshima und Nagasaki , die Techniken zur Zählung photoelektrischer Zellen zu verbessern. Seine Forschung wurde von seinem Bruder Joseph R. Coulter in einem Kellerlabor in Chicago unterstützt. Ihre Ergebnisse mit photoelektrischen Methoden waren enttäuschend, und 1948 entwickelte Wallace nach dem Lesen eines Artikels, in dem die Leitfähigkeit von Blut mit seiner Konzentration roter Blutkörperchen in Beziehung gesetzt wurde, das Coulter-Prinzip - die Theorie, dass eine in einem leitfähigen Medium suspendierte Zelle einen Abfall des Stromproportionals erzeugt auf seine Größe, wenn es durch eine Öffnung geht.
In diesem Oktober baute Wallace einen Zähler, um das Prinzip zu demonstrieren. Aus finanziellen Gründen wurde die Öffnung durch Verbrennen eines Lochs durch ein Stück Zellophan aus einer Zigarettenschachtel hergestellt. Wallace meldete 1949 ein Patent für die Technik an, und 1950 akzeptierte das Office of Naval Research einen Vorschlag zur Finanzierung der Entwicklung des Coulter-Zählers . Wallace Patentanmeldung wurde im Jahr 1953, und nach weiteren Verbesserungen an die Öffnung und die Einführung eines Quecksilber gewährt Manometer präzise Kontrolle über die Probengröße zu liefern, die Brüder gegründet Coulter Electronics Inc. im Jahr 1958 ihre Zähler auf dem Markt. Das Gerät wurde ursprünglich zum Zählen roter Blutkörperchen entwickelt, erwies sich jedoch mit späteren Modifikationen als wirksam zum Zählen weißer Blutkörperchen. Scharzähler wurden von medizinischen Labors weitgehend übernommen.
Der erste Analysator, der mehrere Zellzahlen gleichzeitig erzeugen konnte, war das 1965 veröffentlichte Technicon SMA 4A-7A. Dies wurde erreicht, indem Blutproben in zwei Kanäle aufgeteilt wurden: einen zum Zählen der roten Blutkörperchen und einen zum Zählen der weißen Blutkörperchen und zum Messen des Hämoglobins . Das Instrument war jedoch unzuverlässig und schwer zu warten. 1968 wurde der Coulter Model S-Analysator veröffentlicht und weit verbreitet eingesetzt. Ähnlich wie beim Technicon-Instrument wurden zwei verschiedene Reaktionskammern zur Messung des Hämoglobins und der beiden Zelltypen verwendet. Das Modell S bestimmte auch das mittlere Zellvolumen unter Verwendung von Impedanzmessungen, wodurch die Indizes der roten Blutkörperchen und der Hämatokrit abgeleitet werden konnten. Die automatisierten Thrombozytenzahlen wurden 1970 mit dem Hemalog-8-Instrument von Technicon eingeführt und 1980 von den Analysegeräten der S Plus-Serie von Coulter übernommen.
Nachdem die grundlegende Zellzählung automatisiert worden war, blieb das Differential der weißen Blutkörperchen eine Herausforderung. Die Forschung zur Automatisierung der Differentialzählung begann in den 1970er Jahren und verfolgte zwei Hauptansätze: digitale Bildverarbeitung und Durchflusszytometrie. Unter Verwendung der in den 1950er und 60er Jahren entwickelten Technologie zur Automatisierung des Lesens von Pap-Abstrichen wurden mehrere Modelle von Bildverarbeitungsanalysatoren hergestellt. Diese Instrumente scannten einen gefärbten Blutausstrich, um Zellkerne zu finden, und machten dann eine Momentaufnahme der Zelle mit höherer Auflösung, um sie durch Densitometrie zu analysieren . Sie waren teuer, langsam und trugen wenig zur Verringerung der Arbeitsbelastung im Labor bei, da immer noch Blutausstriche hergestellt und angefärbt werden mussten, sodass Systeme auf der Basis von Durchflusszytometrie immer beliebter wurden und bis 1990 keine digitalen Bildanalysatoren im Handel erhältlich waren USA oder Westeuropa. Diese Techniken erlebten in den 2000er Jahren mit der Einführung fortschrittlicherer Bildanalyseplattformen unter Verwendung künstlicher neuronaler Netze eine Wiederbelebung .
Frühe Durchflusszytometriegeräte schossen Lichtstrahlen auf Zellen in bestimmten Wellenlängen und maßen die resultierende Absorption, Fluoreszenz oder Lichtstreuung, sammelten Informationen über die Merkmale der Zellen und ermöglichten die Quantifizierung von Zellinhalten wie DNA . Ein solches Instrument - das Rapid Cell Spectrophotometer, das 1965 von Louis Kamentsky zur Automatisierung der Zervixzytologie entwickelt wurde - könnte mithilfe zytochemischer Färbetechniken Blutzellstreudiagramme erzeugen. Leonard Ornstein, der bei der Entwicklung des Färbesystems auf dem Rapid Cell Spectrophotometer mitgewirkt hatte, und seine Kollegen entwickelten später den ersten kommerziellen durchflusszytometrischen Differenzialanalysator für weiße Blutkörperchen, den Hemalog D. Dieser 1974 eingeführte Analysator verwendete Lichtstreuung, Absorption und Zelle Färbung zur Identifizierung der fünf normalen Typen weißer Blutkörperchen zusätzlich zu "großen nicht identifizierten Zellen", eine Klassifizierung, die normalerweise aus atypischen Lymphozyten oder Blastenzellen bestand. Der Hemalog D konnte 10.000 Zellen in einem Lauf zählen, eine deutliche Verbesserung gegenüber dem manuellen Differential. 1981 kombinierte Technicon den Hemalog D mit dem Hemalog-8-Analysegerät, um das Technicon H6000 herzustellen, das erste kombinierte vollständige Blutbild- und Differentialanalysegerät. Dieser Analysator war bei hämatologischen Labors unbeliebt, da er arbeitsintensiv zu betreiben war. In den späten 1980er bis frühen 1990er Jahren wurden ähnliche Systeme jedoch häufig von anderen Herstellern wie Sysmex , Abbott , Roche und Beckman Coulter hergestellt .