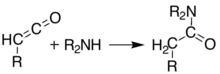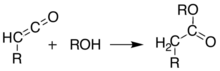Meldrums Säure - Meldrum's acid
|
|
| Namen | |
|---|---|
|
Bevorzugter IUPAC-Name
2,2-Dimethyl-1,3-dioxan-4,6-dion |
|
| Andere Namen
Isopropylidenmalonat
|
|
| Identifikatoren | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA-InfoCard |
100.016.358 |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| C 6 H 8 O 4 | |
| Molmasse | 144,126 g·mol -1 |
| Schmelzpunkt | 94 bis 95 °C (201 bis 203 °F; 367 bis 368 K) (zersetzt) |
| Säure (p K a ) | 4.97 |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
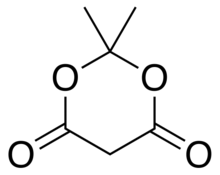
Meldrums Säure oder 2,2-Dimethyl-1,3-dioxan-4,6-dion ist eine organische Verbindung mit der Formel C
6h
8Ö
4. Sein Molekül hat einen heterocyclischen Kern mit vier Kohlenstoff- und zwei Sauerstoffatomen ; die Formel kann auch geschrieben werden als [−O−(C(CH
3)
2)−O−(C=O)−(CH
2)–(C=O)–] .
Es ist ein kristalliner, farbloser Feststoff, der in Wasser schwer löslich ist. Beim Erhitzen zersetzt es sich unter Freisetzung von Kohlendioxid und Aceton .
Eigenschaften
Säure
Die Verbindung kann leicht ein Wasserstoffion verliert aus dem Methylenelement CH
2im Ring (Kohlenstoff 5); wodurch eine Doppelbindung zwischen ihm und einem der benachbarten Kohlenstoffe (Nummer 4 oder 6) und eine negative Ladung im entsprechenden Sauerstoff entsteht. Das resultierende Anion [C
6h
7Ö
4] − wird durch Resonanz zwischen den beiden Alternativen stabilisiert , so dass die Doppelbindung delokalisiert ist und jeder Sauerstoff in den Carbonylen eine Formalladung von −1/2 hat.
Die Ionisationskonstante p K a beträgt 4,97; wodurch es sich wie eine einbasige Säure verhält , obwohl es keine Carbonsäuregruppen enthält . In dieser und anderen Eigenschaften ähnelt die Verbindung Dimedon und Barbitursäure . Doch während Dimedon in Lösung besteht überwiegend als Mono- Enol - Tautomer , Meldrum-Säure ist fast ausschließlich als Diketon Form.
Der ungewöhnlich hohe Säuregehalt dieser Verbindung galt lange Zeit als anormal – sie ist 8 Größenordnungen saurer als die eng verwandte Verbindung Dimethylmalonat . 2004 stellten Ohwada und Mitarbeiter fest, dass die energieminimierende Konformationsstruktur der Verbindung das σ CH- Orbital des Alpha-Protons in die richtige Geometrie bringt , um mit dem π * CO auszurichten , sodass der Grundzustand eine ungewöhnlich starke Destabilisierung der CH-Bindung darstellt.
Vorbereitung
Originalsynthese
Die Verbindung wurde zuerst von Meldrum durch eine Kondensationsreaktion von Aceton mit Malonsäure in Essigsäureanhydrid und Schwefelsäure hergestellt .
Alternative Synthesen
Als Alternative zu seiner ursprünglichen Herstellung kann Meldrums Säure aus Malonsäure, Isopropenylacetat (ein Enol- Derivat von Aceton) und katalytischer Schwefelsäure synthetisiert werden.
Ein dritter Weg ist die Reaktion von Kohlensuboxid C
3Ö
2mit Aceton in Gegenwart von Oxalsäure .
Verwendet
Wie Malonsäure und ihre Esterderivate und andere 1,3-Dicarbonylverbindungen kann und dienen Meldrums Säure als Reaktant für eine Vielzahl von nukleophilen Reaktionen.
Alkylierung und Acylierung
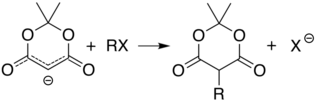
Die Acidität von Kohlenstoff 5 (zwischen den beiden Carbonylgruppen) ermöglicht eine einfache Derivatisierung der Meldrum-Säure an dieser Position durch Reaktionen wie Alkylierung und Acylierung . Zum Beispiel kann die Deprotonierung und Umsetzung mit einem einfachen Alkylhalogenid ( R-Cl ) misst die Alkylgruppe ( R ) an dieser Position:
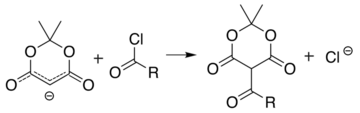
Die analoge Reaktion mit einem Acylchlorid ( R−(C=O)−Cl ) bindet stattdessen das Acyl ( R−(C=O)− ):
Diese beiden Reaktionen ermöglichen es der Meldrum-Säure, als Ausgangsgerüst für die Synthese vieler verschiedener Strukturen mit verschiedenen funktionellen Gruppen zu dienen. Die alkylierten Produkte können weiter manipuliert werden, um verschiedene Amid- und Esterverbindungen herzustellen. Das Erhitzen des Acylprodukts in Gegenwart eines Alkohols führt in einem der Malonestersynthese ähnlichen Verfahren zum Esteraustausch und zur Decarboxylierung . Die reaktive Natur des cyclischen Diesters ermöglicht eine gute Reaktivität sogar für Alkohole, die wie t- Butanol gehindert sind , und diese Reaktivität von Meldrums Säure und ihren Derivaten wurde verwendet, um eine Reihe von Reaktionen zu entwickeln. Ketoester, die aus der Reaktion von Alkoholen mit den Säurederivaten von Meldrum gebildet werden, sind bei der Knorr-Pyrrol-Synthese nützlich .
Synthese von Ketenen
Bei Temperaturen über 200 °C durchläuft die Säure von Meldrum eine perizyklische Reaktion, bei der Aceton und Kohlendioxid freigesetzt werden und eine hochreaktive Ketenverbindung entsteht :
Diese Ketene können durch Flash-Vakuum-Pyrolyse (FVP) isoliert werden . Ketene sind stark elektrophil und können eine Additionsreaktion mit anderen Chemikalien eingehen . Mit diesem Ansatz ist es möglich, neue C-C-Bindungen, Ringe, Amide , Ester und Säuren zu bilden:
Alternativ kann die Pyrolyse in Lösung in einer Eintopfreaktion durchgeführt werden, um die gleichen Ergebnisse zu erhalten, ohne das Keten zu isolieren . Die Fähigkeit, so unterschiedliche Produkte zu bilden, macht Meldrums Säure zu einem sehr nützlichen Reagenz für Synthesechemiker.
Geschichte
Die Verbindung ist nach Andrew Norman Meldrum benannt, der 1908 über ihre Synthese berichtete. Er identifizierte ihre Struktur fälschlicherweise als β- Lacton der β-Hydroxyisopropylmalonsäure ; die korrekte Struktur, das Bislacton von 1,3-Dioxan, wurde 1948 beschrieben.
Verweise
Weiterlesen
- Gerencsér, János; Dorman, György; Darvas, Ferenc (2006). „Meldrums Säure in Mehrkomponentenreaktionen: Anwendungen für die kombinatorische und diversitätsorientierte Synthese“. QSAR & Kombinatorische Wissenschaft . 25 (5–6): 439–448. doi : 10.1002/qsar.200540212 .
- Ivanov, Andrey S. (2008). „Meldrums Säure und verwandte Verbindungen in der Synthese von Naturstoffen und Analoga“. Chem.-Nr. Soz. Rev. 37 (4): 789–811. doi : 10.1039/B716020H .
- Kidd, Hamish (29. Oktober 2008). "Meldrums Säure" . Chemiewelt : 35–36.