Elektrophile aromatische dirigierende Gruppen - Electrophilic aromatic directing groups
Bei einer elektrophilen aromatischen Substitutionsreaktion vorhandene Substituenten - Gruppen auf dem aromatischen Ring beeinflussen die Gesamtreaktionsrate oder eine haben dirigierende Wirkung auf Stellungsisomer der Produkte , die gebildet werden. Eine elektronenspendende Gruppe ( EDG ) oder elektronenfreisetzende Gruppe ( ERG , Z in Strukturformeln) ist ein Atom oder eine funktionelle Gruppe , die einen Teil ihrer Elektronendichte über Resonanz (Mesomerie) oder induktive Effekte (oder Induktion) an ein konjugiertes π-System abgibt. als +M- bzw. +I- Effekte bezeichnet – wodurch das π-System nukleophiler wird . Als Ergebnis dieser elektronischen Effekte ist es wahrscheinlicher , dass ein aromatischer Ring, an den eine solche Gruppe gebunden ist, an einer elektrophilen Substitutionsreaktion teilnimmt. EDGs werden daher oft als aktivierende Gruppen bezeichnet , obwohl sterische Effekte die Reaktion stören können.
Eine elektronenziehende Gruppe (EWG) hat den gegenteiligen Effekt auf die Nukleophilie des Rings. Die EWG entfernt Elektronendichte aus einem π-System, wodurch es bei dieser Art von Reaktion weniger reaktiv wird und daher als desaktivierende Gruppen bezeichnet wird .
EDGs und EWGs bestimmen auch die Positionen (relativ zu sich selbst) am aromatischen Ring, an denen Substitutionsreaktionen am wahrscheinlichsten stattfinden; diese Eigenschaft ist daher in Verfahren der organischen Synthese wichtig .
Elektronenspendende Gruppen sind im Allgemeinen ortho/para-Direktoren für elektrophile aromatische Substitutionen , während elektronenziehende Gruppen im Allgemeinen meta-Direktoren sind, mit Ausnahme der Halogene, die ebenfalls ortho / para- Direktoren sind, da sie einsame Elektronenpaare haben, die mit dem aromatischen Ring geteilt werden.
Kategorien
Elektronenspendende Gruppen werden typischerweise in drei Stufen der Aktivierungsfähigkeit eingeteilt (Die Kategorie "extrem" kann als "stark" angesehen werden). Elektronenentziehende Gruppen werden ähnlichen Gruppierungen zugeordnet. Aktivierende Substituenten begünstigen die elektrophile Substitution an den ortho- und para- Positionen. Schwach desaktivierende Gruppen lenken Elektrophile zum Angriff des Benzolmoleküls in den ortho- und para- Positionen, während stark und mäßig desaktivierende Gruppen Angriffe auf die meta- Position richten . Dabei wird nicht die meta- Position bevorzugt wie para- und ortho-dirigierende funktionelle Gruppen, sondern eher die ortho- und para- Positionen mehr als die meta- Position.
Gruppen aktivieren
Die aktivierenden Gruppen sind meist Resonanzdonatoren (+M). Obwohl viele dieser Gruppen auch induktiv (–I) zurückziehen, was ein deaktivierender Effekt ist, ist der Resonanzeffekt (oder Mesomerieeffekt) fast immer stärker, mit Ausnahme von Cl, Br und I.
| In der Größenordnung von
Aktivierung |
Name des Stellvertreters (in ungefährer Reihenfolge)
der aktivierenden Kraft) |
Struktur | Art des elektronischen Effekts | Richtwirkung |
|---|---|---|---|---|
| Extrem | Oxidogruppe | -O − | +Ich, +M | ortho , para |
| Stark | (substituierte) Aminogruppen | -NH 2 ,
-NHR, -NR 2 |
–Ich, +M | |
| Hydroxy- und Alkoxygruppen | -OH,
-ODER |
|||
| Mäßig | Acylamidogruppen | -NHCOR | ||
| Acyloxygruppen | -OCOR | |||
| (Di)alkylphosphino- , Alkylthio- und Sulfhydrylgruppen | -PR 2 ,
-SR, -NS |
+M (schwach) | ||
| Schwach | Phenyl- (oder Aryl-)Gruppe | -C 6 H 5 | –I, +M; obwohl auch andere Interaktionen beteiligt sein können | |
| Vinylgruppe | -CH = CH 2 | |||
|
Alkylgruppen
(zB -CH 3 , -C 2 H 5 ) |
-R | |||
| Carboxylatgruppe | -CO 2 − | +ich |
Im Allgemeinen ist der Resonanzeffekt von Elementen in der dritten Periode und darüber hinaus relativ schwach. Dies liegt hauptsächlich an der relativ geringen Orbitalüberlappung des 3p-Orbitals (oder höher) des Substituenten mit dem 2p-Orbital des Kohlenstoffs.
Aufgrund eines stärkeren Resonanz- und Induktionseffekts als die schwereren Halogene ist Fluor anormal. Der partielle Geschwindigkeitsfaktor der elektrophilen aromatischen Substitution an Fluorbenzol ist oft größer als eins in der para- Position, was es zu einer aktivierenden Gruppe macht. Umgekehrt ist es an den ortho- und meta- Positionen aufgrund der Nähe dieser Positionen zum elektronegativen Fluorsubstituenten mäßig desaktiviert .
Gruppen deaktivieren
Während sich alle deaktivierenden Gruppen induktiv zurückziehen (–I), ziehen sich die meisten auch durch Resonanz (–M) zurück. Eine Ausnahme bilden Halogensubstituenten: Sie sind Resonanzdonatoren (+M). Mit Ausnahme der Halogenide sind sie meta- dirigierende Gruppen.
Halogenide sind ortho- , para- dirigierende Gruppen, aber im Gegensatz zu den meisten ortho- , para- Direktoren deaktivieren Halogenide das Aren leicht. Dieses ungewöhnliche Verhalten lässt sich durch zwei Eigenschaften erklären:
- Da die Halogene sehr elektronegativ sind, bewirken sie einen induktiven Entzug (Entzug von Elektronen vom Kohlenstoffatom des Benzols).
- Da die Halogene nichtbindende Elektronen haben , können sie durch Pi-Bindung (Resonanzspende) Elektronendichte abgeben.
Die induktiven und die Resonanzeigenschaften konkurrieren miteinander, aber der Resonanzeffekt dominiert, um die Reaktivitätsorte zu lenken. Bei der Nitrierung zum Beispiel lenkt Fluor stark in die para- Position, da die ortho- Position induktiv deaktiviert wird (86% para , 13% ortho , 0,6% meta ). Andererseits lenkt Jod vergleichbar zu ortho- und para- Positionen (54 % para und 45 % ortho , 1,3 % meta ).
| In der Größenordnung von
Deaktivierung |
Name des Stellvertreters (in ungefährer Reihenfolge)
Deaktivierungsstärke) |
Struktur | Art des elektronischen Effekts | Richtwirkung |
|---|---|---|---|---|
| Stark | Trifluormethylsulfonylgruppe | -SO 2 CF 3 | -ICH BIN | Meta |
| (substituierte) Ammoniumgruppen | -NR 3 + (R = Alkyl oder H) | -ICH | ||
| Nitrogruppe | -NEIN 2 | -ICH BIN | ||
| Sulfonsäuren und Sulfonylgruppen | -SO 3 H,
-SO 2 R |
|||
| Cyanogruppe | -C≡N | |||
| Trihalogenmethylgruppen (am stärksten für -CF 3 -Gruppe ) | -CX 3 (X = F, Cl, Br, I) | -ICH | ||
| Mäßig | Halogenformylgruppen | -COX
(X = Cl, Br, I) |
-ICH BIN | |
| Formyl- und Acylgruppen | -CHO,
-KOR |
|||
| Carboxyl- und Alkoxycarbonylgruppen | -CO 2 H,
-CO 2 R |
|||
| (substituierte) Aminocarbonylgruppen | -CONH 2 ,
-CONHR, -KONR 2 |
|||
| Schwach | Fluorgruppe ( ortho , meta- Positionen) | -F | –I, +M ( ortho ) | ortho , para |
| Nitrosogruppe | -N=O | –I, +M (Dimer) oder
–M (Monomer) |
||
| Halo-Gruppen | -F(para), -Cl, -Br, -I | –I, +M (schwach) |
Auswirkungen verschiedener Gruppen auf Benzol
Carbonyle, Sulfonsäuren und Nitro
Aufgrund der vollständigen oder teilweisen positiven Ladung des direkt an den Ring gebundenen Elements für jede dieser Gruppen haben sie alle einen mäßigen bis starken elektronenziehenden induktiven Effekt (bekannt als -I-Effekt). Sie zeigen auch elektronenziehende Resonanzeffekte (bekannt als -M-Effekt):
Somit machen diese Gruppen den aromatischen Ring im Vergleich zu Benzol sehr elektronenarm (δ+) und deaktivieren daher den Ring stark (dh Reaktionen laufen in Ringen mit diesen Gruppen viel langsamer ab als in Benzol).
Aniline , Phenole und Ether (wie Anisol )
Aufgrund des Elektronegativitätsunterschieds zwischen Kohlenstoff und Sauerstoff/Stickstoff kommt es zu einem leichten elektronenziehenden Effekt durch induktiven Effekt (bekannt als –I-Effekt). Der andere als Resonanz bezeichnete Effekt fügt dem Ring jedoch die Elektronendichte zurück (bekannt als der +M-Effekt) und dominiert den des induktiven Effekts. Daraus ergibt sich, dass es sich um EDGs und Ortho / Para- Direktoren handelt.
Phenol ist ein ortho/para-Direktor, aber in Gegenwart einer Base ist die Reaktion schneller. Dies ist auf die höhere Reaktivität des Phenolatanions zurückzuführen . Der negative Sauerstoff wurde "gezwungen", den Kohlenstoffen Elektronendichte zu verleihen (da er eine negative Ladung hat, hat er einen zusätzlichen +I-Effekt). Auch im kalten Zustand und mit neutralen (und relativ schwachen) Elektrophilen läuft die Reaktion noch schnell ab.
Alkylgruppen
Alkylgruppen sind elektronenspendende Gruppen. Der Kohlenstoff darauf ist sp 3 -hybridisiert und weniger elektronegativ als diejenigen, die sp 2 -hybridisiert sind . Sie überlappen an den Kohlenstoff-Wasserstoff-Bindungen (oder Kohlenstoff-Kohlenstoff-Bindungen in Verbindungen wie tert- Butylbenzol) mit dem Ring-p-Orbital. Daher sind sie reaktiver als Benzol und sind ortho / para- Direktoren.
Carboxylat
Induktiv stößt das negativ geladene Carboxylat-Ion die Elektronen in der Bindung, die es an den Ring bindet, mäßig ab. Somit liegt ein schwacher elektronenspendender +I-Effekt vor. Es gibt einen nahezu Null-M-Effekt, da die elektronenziehende Resonanzkapazität der Carbonylgruppe durch die Delokalisierung der negativen Ladung des Anions auf dem Sauerstoff effektiv entfernt wird. Insgesamt hat also die Carboxylatgruppe (im Gegensatz zur Carboxylgruppe ) einen aktivierenden Einfluss.
Alkylammonium- und Trifluormethylgruppe
Diese Gruppen haben entweder aufgrund ihrer positiven Ladung oder aufgrund der starken Elektronegativität der Halogene eine starke elektronenziehende induktive Wirkung (-I). Es gibt keinen Resonanzeffekt, weil es keine Orbitale oder Elektronenpaare gibt, die mit denen des Rings überlappen können. Der induktive Effekt wirkt wie der für das Carboxylat-Anion, jedoch in die entgegengesetzte Richtung (dh er erzeugt kleine positive Ladungen an den ortho- und para- Positionen, aber nicht an der meta- Position und destabilisiert das Wheland-Intermediat .) Daher sind diese Gruppen desaktivierend und meta- dirigieren :
Halogenide konkurrierende Effekte
Induktion versus Resonanz
Fluor ist unter diesen Umständen eine Anomalie. Oben wurde sie als schwach elektronenziehende Gruppe beschrieben, aber dies ist nur teilweise richtig. Es ist richtig, dass Fluor einen -I-Effekt hat, der dazu führt, dass Elektronen induktiv entzogen werden. Ein weiterer Effekt, der eine Rolle spielt, ist jedoch der +M-Effekt, der die Elektronendichte wieder in den Benzolring zurückführt (und somit den entgegengesetzten Effekt des -I-Effekts hat, jedoch durch einen anderen Mechanismus). Dies wird als mesomerer Effekt (daher +M) bezeichnet und das Ergebnis für Fluor ist, dass der +M-Effekt den -I-Effekt ungefähr aufhebt. Dies führt für Fluorbenzol in para- Position zu einer Reaktivität, die mit der von Benzol vergleichbar (oder sogar höher) ist . Da induktive Effekte stark von der Nähe abhängen, sind die meta- und ortho- Positionen von Fluorbenzol erheblich weniger reaktiv als Benzol. So elektrophile aromatische Substitution auf Fluor ist stark para selektiv.
Dieser -I- und +M-Effekt gilt für alle Halogenide - jedes hat einen gewissen elektronenziehenden und -spendenden Charakter. Um zu verstehen, warum die Reaktivitätsänderungen auftreten, müssen wir die Orbitalüberlappungen berücksichtigen, die in jedem auftreten. Die Valenzorbitale von Fluor sind die 2p-Orbitale, die für Kohlenstoff gleich sind - daher sind sie energetisch sehr nahe und die Orbitalüberlappung ist günstig. Chlor hat 3p-Valenzorbitale, daher sind die Orbitalenergien weiter auseinander und die Geometrie ungünstiger, was zu weniger Donation und Stabilisierung des carbokationischen Zwischenprodukts führt, daher ist Chlorbenzol weniger reaktiv als Fluorbenzol . Allerdings Brombenzol und Iodbenzol ist in etwa gleich oder ein wenig reaktiver als Chlorbenzol, denn obwohl die Resonanz Spende ist noch schlimmer, der induktive Effekt auch aufgrund ihrer geringeren Elektronegativität geschwächt ist. Somit ist die Gesamtreaktivitätsordnung U-förmig, mit einem Minimum bei Chlorbenzol/Brombenzol (relative Nitrierungsraten im Vergleich zu Benzol = 1 in Klammern): PhF (0.18) > PhCl (0.064) ~ PhBr ( 0.060 ) < PhI (0.12) . Trotzdem reagieren alle Halogenbenzole langsamer als Benzol selbst.
Beachten Sie, dass Iodbenzol immer noch weniger reaktiv ist als Fluorbenzol, da auch die Polarisierbarkeit eine Rolle spielt. Dies kann auch erklären, warum Phosphor in Phosphanen keine Elektronendichte durch Induktion an Kohlenstoff abgeben kann (dh +I-Effekt), obwohl es weniger elektronegativ ist als Kohlenstoff (2,19 vs 2,55, siehe Elektronegativitätsliste ) und warum Iodwasserstoffsäure ( pKa = -10) viel saurer als Flusssäure (pKa = 3). (Das ist 10 13 mal sauer als Flusssäure)
Richtwirkung
Aufgrund des einsamen Elektronenpaares stehen Halogengruppen für die Abgabe von Elektronen zur Verfügung. Sie sind daher ortho / para- Direktoren.
Nitroso-Gruppe
Induktion
Aufgrund des Elektronegativitätsunterschieds zwischen Kohlenstoff und Stickstoff hat die Nitrosogruppe einen relativ starken -I-Effekt, aber nicht so stark wie die Nitrogruppe. (Positiv geladene Stickstoffatome an Alkylammoniumkationen und an Nitrogruppen haben einen viel stärkeren -I-Effekt)
Resonanz
Die Nitrosogruppe hat sowohl einen +M- als auch einen -M-Effekt, jedoch ist der -M-Effekt günstiger.
Stickstoff hat ein einsames Elektronenpaar. Das freie Elektronenpaar seiner Monomerform ist jedoch ungünstig, um durch Resonanz zu spenden. Für den +M-Effekt steht nur die Dimerform zur Verfügung. Die Dimerform ist jedoch in einer Lösung weniger stabil. Daher steht die Nitrosogruppe weniger zur Abgabe von Elektronen zur Verfügung.
Umgekehrt ist das Entziehen der Elektronendichte günstiger: (siehe Bild rechts).
Als Ergebnis ist die Nitrosogruppe ein Desaktivator. Es kann jedoch während des Wheland-Intermediats Elektronendichte an den Benzolring abgeben , wodurch es immer noch ein ortho / para- Direktor ist .
Sterische Effekte
Am Benzol gibt es 2 ortho- Positionen, 2 meta- Positionen und 1 para- Position, wenn eine Gruppe daran gebunden ist. Wenn eine Gruppe ein Ortho/Para- Direktor ist, wobei Ortho- und Para- Positionen mit dem gleichen Teilratenfaktor reagieren, würden wir aufgrund dieses statistischen Effekts doppelt so viel Ortho- Produkt wie Para- Produkt erwarten . Die Teilratenfaktoren an den ortho- und para- Positionen sind jedoch im Allgemeinen nicht gleich. Im Fall eines Fluorsubstituenten zum Beispiel ist der ortho- Partialgeschwindigkeitsfaktor aufgrund eines stärkeren induktiven Rückzugseffekts an der ortho- Position viel kleiner als der para . Abgesehen von diesen Effekten gibt es oft auch einen sterischen Effekt aufgrund einer erhöhten sterischen Hinderung an der ortho- Position, aber nicht an der para- Position, was zu einer größeren Menge des para- Produkts führt.
Der Effekt wird für elektrophile aromatische Substitutionen mit Alkylsubstituenten unterschiedlichen sterischen Anspruchs für die elektrophile aromatische Nitrierung veranschaulicht.
| Substrat | Toluol [-CH 3 ] |
Ethylbenzol
[-CH 2 CH 3 ] |
cumol
[-CH(CH 3 ) 2 ] |
tert- Butylbenzol
[-C(CH 3 ) 3 ] |
|---|---|---|---|---|
| ortho- Produkt | 58 | 45 | 30 | 16 |
| Meta - Produkt | 5 | 6 | 8 | 11 |
| Para- Produkt | 37 | 59 | 62 | 73 |
| ortho/para- Verhältnis | 1,57 | 0,76 | 0,48 | 0,22 |
Die Methylgruppe in Toluol ist klein und führt dazu, dass das ortho- Produkt das Hauptprodukt ist. Andererseits ist die t- Butylgruppe sehr voluminös (es sind 3 Methylgruppen an einen einzelnen Kohlenstoff gebunden) und führt das para- Produkt als Hauptprodukt. Selbst mit Toluol ist das Produkt nicht 2:1, sondern weist ein etwas weniger ortho- Produkt auf.
Dirigierende Wirkung auf mehrere Substituenten
Wenn bereits zwei Substituenten am Ring vorhanden sind, befindet sich der dritte Substituent an einer lokalisierten Stelle. Für den Substituenten gelten folgende Regeln:
- Wenn zwei ortho / para- Direktoren meta zueinander sind, befindet sich der dritte Substituent nicht zwischen ihnen.
- Wenn sowohl ein ortho / para- Direktor als auch ein meta- Direktor am Ring vorhanden sind, hängt der Platz des dritten Substituenten vom ortho / para- Direktor ab.
- Wenn beide Gruppen der gleiche Direktor sind, hängt der dritte Substituent vom stärkeren ab.
- Wenn beide Gruppen eine ähnliche dirigierende Wirkung haben und para zueinander stehen, hängt der dritte Substituent von dem weniger gehinderten ab.
Rationalisierung von Richteffekten
Auch wenn sterische Effekte eine Rolle spielen, ist die wichtigste Erklärung für elektronenschiebende und elektronenziehende Gruppen ihre Störung der elektronischen Verteilung des aromatischen Rings, meist über mesomere Effekte, die sich über das gesamte konjugierte System erstrecken, um Bereiche mit übermäßiger oder mangelhafter π Elektronendichte. Die Betrachtung von Resonanzformen ist in dieser Hinsicht nützlich, da sie ein bequemes Mittel zur Bestimmung der Orte dieser Störungen bieten. Genauer gesagt spiegeln alle formalen negativen oder positiven Ladungen in kleineren Resonanzbeiträgen (solche, die der natürlichen Polarisation entsprechen, aber nicht unbedingt der Oktettregel gehorchen ) Orte mit einem größeren bzw ). Ein Kohlenstoffatom mit einem größeren Koeffizienten wird aufgrund der günstigeren Orbitalüberlappung mit dem Elektrophil bevorzugt angegriffen.
Die Störung einer konjugierenden elektronenziehenden oder elektronenspendenden Gruppe bewirkt, dass die π-Elektronenverteilung der des elektronenarmen Benzylkations bzw diese Grenzfälle. Daher können wir diese einfachen Spezies, deren π-Elektronenverteilung mit der einfachen Hückel-Theorie berechnet werden kann , als Modelle verwenden, um das regiochemische Ergebnis der elektrophilen aromatischen Substitution zu erklären . Wie zu sehen ist, ist die π-Elektronenpopulation an den ortho- und para- Positionen für den Fall einer elektronenziehenden Gruppe verarmt, wodurch ein meta- Angriff als die am wenigsten ungünstige Option auftritt. Im Gegensatz dazu haben die ortho- und para- Positionen , wenn eine elektronenspendende Gruppe vorhanden ist, eine erhöhte π-Elektronenpopulation im Vergleich zur meta- Position, was den Angriff an den ortho- und para- Positionen gegenüber der meta- Position begünstigt .
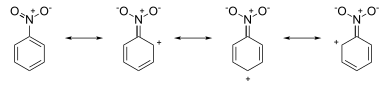
Dies ist genau das Ergebnis, das das Zeichnen von Resonanzstrukturen vorhersagen würde. In Nitrobenzol beispielsweise haben die Resonanzstrukturen positive Ladungen um das Ringsystem (siehe Bild unten):
Der Angriff erfolgt an der meta- Position, da die ortho- und para- Positionen (teilweise) formal positive Ladungen aufweisen, die auf einen π-Elektronenmangel an diesen Positionen hinweisen, wodurch die meta- Positionen eine etwas höhere Elektronendichte hinterlassen . Bei Anilin hingegen haben die Resonanzstrukturen negative Ladungen um das Ringsystem (siehe Bild unten):
Der Angriff erfolgt an den ortho- und para- Positionen, die (partielle) formal negative Ladungen aufweisen, die einen π-Elektronenüberschuss an diesen Positionen anzeigen.
Ein weiteres häufiges Argument, das identische Vorhersagen macht, betrachtet die Stabilisierung oder Destabilisierung der Wheland-Zwischenstufen durch Substituenten, die aus einem elektrophilen Angriff an den ortho / para- oder meta- Positionen resultieren . Das Hammond-Postulat schreibt dann vor, dass die relativen Übergangszustandsenergien die Unterschiede in den Grundzustandsenergien der Wheland-Zwischenstufen widerspiegeln. ( Siehe elektrophile aromatische Substitution für Einzelheiten zu diesem Argument. )
Die bei EDGs und EWGs beobachteten Selektivitäten wurden erstmals 1892 beschrieben und sind als Crum Brown-Gibson-Regel bekannt .